
Structura, proprietățile și utilizările fosfatului de calciu (Ca3 (PO4) 2)

fosfat de calciu este o sare anorganică și terțiară a cărei formulă chimică este Ca3(PO4)Două. Formula afirmă că compoziția acestei sări este de 3: 2 pentru calciu, respectiv fosfat. Acest lucru poate fi văzut direct în imaginea de mai jos, unde este afișat cationul Ca.Două+ și anionul PO43-. Pentru fiecare trei Ca.Două+ există două OP43- interacționând cu ei.
Pe de altă parte, fosfatul de calciu se referă la o serie de săruri care variază în funcție de raportul Ca / P, precum și de gradul de hidratare și pH. De fapt, există multe tipuri de fosfați de calciu care există și pot fi sintetizați. Cu toate acestea, ca urmare a nomenclaturii la litera, fosfatul de calciu se referă doar la tricalciul, menționat anterior.

Toți fosfații de calciu, inclusiv Ca3(PO4)Două, sunt de culoare albă solidă, cu ușoare nuanțe cenușii. Ele pot fi granulare, fine, cristaline și au dimensiuni ale particulelor de aproximativ microni; și chiar au fost preparate nanoparticule ale acestor fosfați, cu care sunt concepute materiale biocompatibile pentru oase.
Această biocompatibilitate se datorează faptului că aceste săruri se găsesc în dinți și, pe scurt, în țesuturile osoase ale mamiferelor. De exemplu, hidroxiapatita este un fosfat de calciu cristalin, care la rândul său interacționează cu o fază amorfă a aceleiași sări..
Aceasta înseamnă că există fosfați de calciu amorfi și cristalini. Din acest motiv, nu este surprinzător diversitatea și opțiunile multiple la sintetizarea materialelor pe bază de fosfați de calciu; materiale în ale căror proprietăți în fiecare zi mai mulți cercetători sunt interesați în întreaga lume să se concentreze asupra restaurării oaselor.
Indice articol
- 1 Structura fosfatului de calciu
- 1.1 Fosfat de calciu amorf
- 1.2 Restul familiei
- 2 Proprietăți fizice și chimice
- 2.1 Denumiri
- 2.2 Greutate moleculară
- 2.3 Descrierea fizică
- 2.4 Aromă
- 2.5 Punct de topire
- 2.6 Solubilitate
- 2.7 Densitate
- 2.8 Indicele de refracție
- 2.9 Entalpia standard de formare
- 2.10 Temperatura de depozitare
- 2.11 pH
- 3 Instruire
- 3.1 Azotat de calciu și hidrogen fosfat de amoniu
- 3.2 Hidroxid de calciu și acid fosforic
- 4 utilizări
- 4.1 În țesutul osos
- 4.2 Cimenturi bioceramice
- 4.3 Medici
- 4.4 Altele
- 5 Referințe
Structura fosfatului de calciu
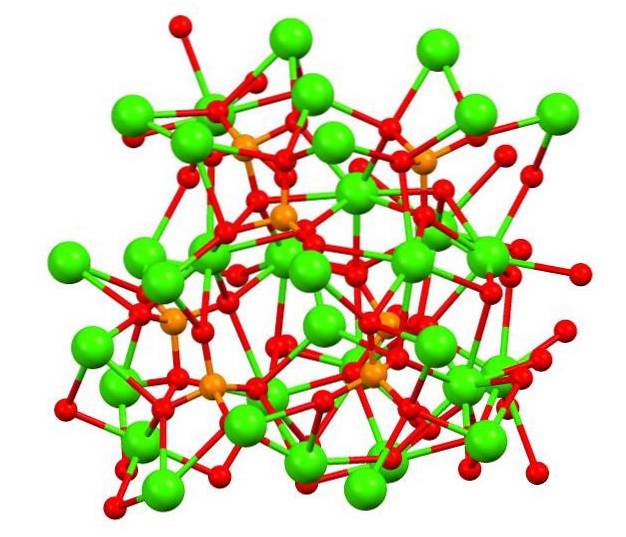
Imaginea superioară arată structura fosfatului calico tribazic în ciudatul mineral whitlockite, care poate conține magneziu și fier ca impurități..
Deși la prima vedere poate părea complex, este necesar să clarificăm că modelul presupune interacțiuni covalente între atomii de oxigen ai fosfaților și centrele metalice ale calciului..
Cu titlu de reprezentare este valabil, cu toate acestea, interacțiunile sunt electrostatice; adică cationii CaDouă+ sunt atrași de anioni PO43- (ACDouă+- O-PO33-). Având în vedere acest lucru, se înțelege de ce în imagine calciul (sferele verzi) sunt înconjurate de atomii de oxigen încărcați negativ (sferele roșii).
Deoarece există atât de mulți ioni, nu lasă vizibil un aranjament simetric sau un model. Ca.3(PO4)Două adoptă la temperaturi scăzute (T<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)Două (β-TCP).
La temperaturi ridicate, pe de altă parte, se transformă în polimorf α-Ca3(PO4)Două (α-TCP), a cărei celulă unitară corespunde unui sistem de cristal monoclinic. La temperaturi și mai ridicate, se poate forma și polimorful α'-Ca.3(PO4)Două, care este de structură cristalină hexagonală.
Fosfat de calciu amorf
Structurile cristaline au fost menționate pentru fosfatul de calciu, ceea ce este de așteptat de la o sare. Cu toate acestea, este capabil să prezinte structuri dezordonate și asimetrice, legate mai mult de un tip de „sticlă de fosfat de calciu” decât de cristale în sensul strict al definiției sale..
Când se întâmplă acest lucru, se spune că fosfatul de calciu are o structură amorfă (ACP, fosfat de calciu amorf). Mai mulți autori indică acest tip de structură ca fiind responsabil pentru proprietățile biologice ale Ca.3(PO4)Două în țesuturile osoase, repararea și biomimetizarea acestuia fiind posibilă.
Prin elucidarea structurii sale prin rezonanță magnetică nucleară (RMN), s-a constatat prezența ionilor OH- și HPO4Două- în ACP. Acești ioni sunt formați prin hidroliza unuia dintre fosfați:
PO43- + HDouăSAU <=> HPO4Două- + Oh-
Ca rezultat, adevărata structură a ACP devine mai complexă, a cărei compoziție a ionilor săi este reprezentată de formula: Ca9(PO4)6-x(HPO4)X(OH)X. „X” indică gradul de hidratare, deoarece dacă x = 1, atunci formula ar fi următoarea: Ca9(PO4)5(HPO4) (OH).
Diferitele structuri pe care le poate avea ACP depind de raporturile molare Ca / P; adică a cantităților relative de calciu și fosfat, care își schimbă întreaga compoziție rezultată.
Restul familiei
Fosfații de calciu sunt de fapt o familie de compuși anorganici, care la rândul lor pot interacționa cu o matrice organică.
Ceilalți fosfați sunt obținuți „simplu” prin schimbarea anionilor care însoțesc calciul (PO43-, HPO4Două-, HDouăPO4-, Oh-), precum și tipul de impurități din solid. Astfel, până la unsprezece sau mai mulți fosfați de calciu, fiecare cu structura și proprietățile sale, pot fi originate în mod natural sau artificial..
Unii fosfați și structurile și formulele lor chimice respective vor fi menționate mai jos:
-Hidrogen fosfat de calciu dihidrat, CaHPO4∙ 2HDouăO: monoclinic.
-Dihidrogen fosfat de calciu monohidrat, Ca (HDouăPO4)Două∙ HDouăSau: triclinic.
-Fosfat diacid anhidru, Ca (HDouăPO4)Două: triclinic.
-Fosfat de hidrogen octacalcic (OCP), Ca8HDouă(PO4)6: triclinic. Este un precursor în sinteza hidroxiapatitei.
-Hidroxiapatită, Ca5(PO4)3OH: hexagonal.
Proprietati fizice si chimice
Numele
-Fosfat de calciu
-Fosfat tricalcic
-Difosfat tricalcic
Greutate moleculară
310,74 g / mol.
Descriere Fizica
Este un solid alb inodor.
Gust
Fără gust.
Punct de topire
1670 ºK (1391 ºC).
Solubilitate
-Practic insolubil în apă.
-Insolubil în etanol.
-Solubil în acid clorhidric diluat și acid azotic.
Densitate
3,14 g / cm3.
Indicele de refracție
1.629
Entalpia standard de formare
4126 kcal / mol.
Temperatura de depozitare
2-8 ºC.
pH
6-8 într-o suspensie apoasă de 50 g / L de fosfat de calciu.
Instruire
Azotat de calciu și hidrogen fosfat de amoniu
Există numeroase metode de producere sau formare a fosfatului de calciu. Una dintre ele constă dintr-un amestec de două săruri, Ca (NO3)Două∙ 4HDouăO și (NH4)DouăHPO4, dizolvate anterior în alcool absolut și, respectiv, în apă. O sare furnizează calciu, iar cealaltă oferă fosfat.
Din acest amestec precipită ACP, care este apoi supus încălzirii într-un cuptor la 800 ° C timp de 2 ore. Ca urmare a acestei proceduri, se obține β-Ca3(PO4)Două. Prin controlul atent al temperaturilor, al agitației și al timpilor de contact, poate apărea formarea nanocristalelor.
Pentru a forma polimorful α-Ca3(PO4)Două este necesar să se încălzească fosfatul peste 1000 ° C. Această încălzire se efectuează în prezența altor ioni metalici, care stabilizează suficient acest polimorf astfel încât să poată fi utilizat la temperatura camerei; adică rămâne într-o stare meta stabilă.
Hidroxid de calciu și acid fosforic
Fosfatul de calciu se poate forma și prin amestecarea soluțiilor de hidroxid de calciu și acid fosforic, producând o neutralizare acid-bazică. După o jumătate de zi de maturare în băuturile mamă și filtrarea, spălarea, uscarea și cernerea lor corespunzătoare, se obține o pulbere granulară de fosfat amorf, ACP..
Acest ACP reacționează la temperaturi ridicate, transformându-se conform următoarelor ecuații chimice:
2Ca9(HPO4) (PO4)5(OH) => 2Ca9(PDouăSAU7)0,5(PO4)5(OH) + HDouăO (la T = 446,60 ° C)
2Ca9(PDouăSAU7)0,5(PO4)5(OH) => 3Ca3(PO4)Două + 0,5HDouăO (la T = 748,56 ° C)
În acest fel se obține β-Ca3(PO4)Două, cel mai comun și stabil polimorf al acestuia.
Aplicații
În țesutul osos
Ca.3(PO4)Două este principalul constituent anorganic al cenușei osoase. Este o componentă a transplanturilor de înlocuire osoasă, acest lucru fiind explicat prin similitudinea sa chimică cu mineralele prezente în os.
Biomaterialele cu fosfat de calciu sunt utilizate pentru corectarea defectelor osoase și pentru acoperirea protezelor metalice din titan. Fosfatul de calciu este depus pe ele, izolându-le de mediu și încetinind procesul de coroziune a titanului..
Fosfați de calciu, inclusiv Ca3(PO4)Două, Sunt folosite pentru realizarea materialelor ceramice. Aceste materiale sunt biocompatibile și sunt utilizate în prezent pentru a restabili pierderea osoasă alveolară rezultată din boala parodontală, infecțiile endodontice și alte afecțiuni..
Cu toate acestea, acestea trebuie utilizate numai pentru a accelera repararea oaselor periapicale, în zonele în care nu există infecție bacteriană cronică..
Fosfatul de calciu poate fi utilizat pentru repararea defectelor osoase atunci când nu se poate utiliza o grefă osoasă autogenă. Poate fi utilizat singur sau în combinație cu un polimer biodegradabil și resorbabil, cum ar fi acidul poliglicolic.
Cimenturi bioceramice
Cimentul cu fosfat de calciu (CPC) este un alt bioceramic utilizat în repararea țesutului osos. Se face prin amestecarea pulberii diferitelor tipuri de fosfați de calciu cu apă, formând o pastă. Pasta poate fi injectată sau montată pe defectul sau cavitatea osoasă.
Cimenturile sunt turnate, resorbite treptat și înlocuite cu os nou format.
Medici
-Ca.3(PO4)Două Este o sare de bază, deci este utilizată ca antiacid pentru neutralizarea excesului de arsuri la stomac și creșterea pH-ului. În pastele de dinți oferă o sursă de calciu și fosfat pentru a facilita procesul de remineralizare a dinților și a hemostazei osoase..
-Este, de asemenea, utilizat ca supliment nutritiv, deși cel mai ieftin mod de a furniza calciu este prin utilizarea carbonatului și citratului acestuia..
-Fosfatul de calciu poate fi utilizat în tratamentul tetaniei, hipocalcemiei latente și terapiei de întreținere. În plus, este util în suplimentarea cu calciu în timpul sarcinii și alăptării..
-Este utilizat în tratamentul contaminării cu izotopi radioactivi radio (Ra-226) și stronțiu (Sr-90). Fosfatul de calciu blochează absorbția izotopilor radioactivi în tractul digestiv, limitând astfel daunele cauzate de aceștia.
Alții
-Fosfatul de calciu este folosit ca furaj pentru păsări. În plus, este utilizat în pastele de dinți pentru controlul tartrului..
-Este folosit ca agent anti-aglomerare, de exemplu pentru a preveni compactarea sării de masă.
-Funcționează ca agent de albire a făinii. Între timp, în untură previne colorarea nedorită și îmbunătățește starea prăjirii..
Referințe
- Tung M.S. (1998) Fosfații de calciu: structură, compoziție, solubilitate și stabilitate. În: Amjad Z. (eds) Fosfați de calciu în sisteme biologice și industriale. Springer, Boston, MA.
- Langlang Liu, Yanzeng Wu, Chao Xu, Suchun Yu, Xiaopei Wu și Honglian Dai. (2018). „Sinteza, caracterizarea fosfatului nano-β-tricalcic și inhibarea celulelor carcinomului hepatocelular”, Journal of Nanomaterials, vol. 2018, ID articol 7083416, 7 pagini, 2018.
- Combes, Hristos și Rey, creștin. (2010). Fosfați de calciu amorfi: sinteză, proprietăți și utilizări în biomateriale. Acta Biomaterialia, vol. 6 (nr. 9). pp. 3362-3378. ISSN 1742-7061
- Wikipedia. (2019). Fosfat tricalcic. Recuperat de pe: en.wikipedia.org
- Abida și colab. (2017). Pulbere de fosfat tricalcic: Abilități de preparare, caracterizare și compactare. Jurnalul Mediteraneean de Chimie 2017, 6 (3), 71-76.
- PubChem. (2019). Fosfat de calciu. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Elsevier. (2019). Fosfat de calciu. Știință directă. Recuperat de pe: sciencedirect.com



Nimeni nu a comentat acest articol încă.