
Structura fosfurii de aluminiu (AIP), proprietăți, utilizări, riscuri
fosfura de aluminiu Este un compus anorganic format dintr-un atom de aluminiu (Al) și un atom de fosfor (P). Formula sa chimică este AlP. Este un gri închis solid sau, dacă este foarte pur, galben. Este un compus extrem de toxic pentru ființele vii.
Fosfura de aluminiu reacționează cu umezeala pentru a forma fosfină sau fosfan PH3, care este un gaz otrăvitor. Din acest motiv, AlP nu trebuie să intre în contact cu apa. Reacționează puternic cu acizi și soluții alcaline.

A fost folosit în trecut pentru a elimina dăunătorii precum insectele și rozătoarele din locurile în care erau depozitate cerealele și alte produse agricole. Cu toate acestea, din cauza pericolului său ridicat, a fost interzis în majoritatea țărilor lumii..
În prezent, utilitatea sa în zona electronică este investigată teoretic folosind computere care calculează posibilitatea de a obține nanotuburi AlP semiconductoare, adică tuburi extrem de mici care pot transmite electricitate numai în anumite condiții..
Fosfura de aluminiu este un compus foarte periculos, trebuie manipulat cu instrumente de siguranță precum mănuși, ochelari, aparate de respirat și îmbrăcăminte de protecție..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Densitatea
- 3.5 Solubilitate
- 3.6 Proprietăți chimice
- 3.7 Alte proprietăți
- 4 Obținerea
- 5 utilizări
- 5.1 În eliminarea dăunătorilor (utilizarea întreruptă)
- 5.2 În alte aplicații
- 6 Investigația teoretică a nanotuburilor AlP
- 6.1 Nanotuburi AlP cu bor
- 6.2 Nanotuburi AlP cu structură modificată
- 7 Riscuri
- 8 Referințe
Structura
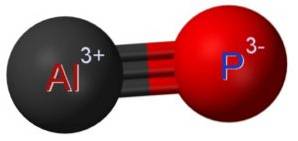
Fosfura de aluminiu AlP este formată prin uniunea unui atom de aluminiu Al și a unui atom de fosfor P. Legătura dintre ambele este covalentă și triplă, prin urmare este foarte puternică.
Aluminiul din AlP are o stare de oxidare de +3, iar fosforul are o valență de -3.
Nomenclatură
- Fosfură de aluminiu
Proprietăți
Starea fizică
Solid cristalin de culoare gri închis sau galben închis sau verde. Cristale cubice.
Greutate moleculară
57.9553 g / mol
Punct de topire
2550 ºC
Densitate
2,40 g / cm3 la 25 ° C
Solubilitate
Se descompune în apă.
Proprietăți chimice
Reacționează cu umezeala pentru a da fosfină sau fosfan PH3 care este un compus inflamabil și otrăvitor. Fosfina sau fosfana se aprind spontan la contactul cu aerul, cu excepția cazului în care există apă în exces.
Reacția fosfurii de aluminiu cu apa este următoarea:
Fosfură de aluminiu + apă → Hidroxid de aluminiu + fosfină
AlP + 3 HDouăO → Al (OH)3 + PH3↑
Prezentările comerciale au carbonat de aluminiu AlDouă(CO3)3 pentru a preveni autoinflamarea cu fosfină care apare atunci când AlP intră în contact cu umiditatea din aer.
AlP este stabil când este uscat. Reacționează violent cu acizi și soluții alcaline.
Fosfura de aluminiu AlP nu se topește, sublimă sau se descompune termic la temperaturi de până la 1000 ° C. Chiar și la această temperatură, presiunea sa de vapori este foarte mică, adică nu se evaporă la temperatura respectivă..
Când este încălzit până la descompunere, emite oxizi de fosfor toxici. În contact cu metalele poate emite gaze de hidrogen inflamabile HDouă.
Alte proprietăți
Când este pur prezintă o colorație gălbuie, când este amestecat cu reziduuri ale reacției de preparare prezintă o culoare de la gri la negru..
Volatilitatea sa scăzută îl exclude de la orice miros, astfel încât mirosul de usturoi pe care îl emite uneori se datorează fosfinei PH3 care se formează în prezența umezelii.
Obținerea
Fosfura de aluminiu poate fi obținută prin încălzirea unui amestec de aluminiu praf metalic (Al) și a elementului fosfor roșu (P).
Datorită afinității fosforului (P) pentru oxigen (ODouă) și cea a aluminiului (Al) prin oxigen și azot (NDouă), reacția trebuie efectuată într-o atmosferă lipsită de aceste gaze, de exemplu într-o atmosferă de hidrogen (HDouă) sau gaz natural.
Reacția este pornită prin încălzirea rapidă a unei zone a amestecului până când începe reacția, care este exotermă (căldura este produsă în timpul reacției). Din acel moment reacția se desfășoară rapid.
Aluminiu + Fosfor → Fosfură de aluminiu
4 Al + P4 → 4 AlP
Aplicații
În eliminarea dăunătorilor (utilizarea întreruptă)
Fosfura de aluminiu a fost folosită în trecut ca insecticid și ca ucigaș de rozătoare. Cu toate acestea, deși a fost interzis pentru toxicitate, este încă utilizat în unele părți ale lumii..
Se folosește pentru fumigarea în spații închise unde există produse alimentare agricole procesate sau neprelucrate (cum ar fi cerealele), furaje pentru animale și produse nealimentare.
Scopul este de a controla insectele și rozătoarele care atacă obiectele stocate, indiferent dacă sunt comestibile sau nu..
Permite controlul rozătoarelor și insectelor în zonele non-domestice, agricole sau neagricole, pulverizând în aer liber sau în vizuini și cuiburi pentru a le împiedica să transmită anumite boli.


Forma sa de utilizare constă în expunerea AlP la aer sau umiditate, deoarece se eliberează PH fosfină sau fosfan.3 care dăunează multor organe ale dăunătorului pentru a fi eliminate.

În alte aplicații
Fosfura de aluminiu AlP este utilizată ca sursă de fosfină sau fosfan PH3 și este utilizat în cercetarea semiconductorilor.
Investigarea teoretică a nanotuburilor AlP
Au fost efectuate studii teoretice privind formarea nanotuburilor de fosfură de aluminiu AlP. Nanotuburile sunt cilindri foarte mici și foarte subțiri care pot fi vizibili doar cu un microscop electronic..
Nanotuburi AlP cu bor
Studiile teoretice efectuate prin calcule arată că impuritățile care ar putea fi adăugate la nanotuburile AlP ar putea modifica proprietățile teoretice ale acestor.
De exemplu, se estimează că adăugarea atomilor de bor (B) la nanotuburile AlP le-ar putea transforma în semiconductori-p. Un semiconductor este un material care se comportă ca un conductor de electricitate sau ca un izolator în funcție de câmpul electric la care este supus.
Și un tip semiconductor-p Acesta este momentul în care se adaugă impurități la material, în acest caz AlP este materia primă și atomii de bor ar fi impuritățile. Semiconductorii sunt utili pentru aplicațiile electronice.
Nanotuburi AlP cu structură modificată
Unii oameni de știință au efectuat calcule pentru a determina efectul schimbării structurii de rețea cristalină a nanotuburilor AlP de la hexagonal la octaedric..
Ei au descoperit că manipularea structurii rețelelor ar putea fi utilizată pentru a regla fin conductibilitatea și reactivitatea nanotuburilor AlP și a le proiecta astfel încât să fie utile pentru aplicații electronice și optice..
Riscuri
Contactul cu fosfura de aluminiu poate irita pielea, ochii și membranele mucoase. Dacă este înghițit sau inhalat, este toxic. Poate fi absorbit prin piele cu efecte toxice.
Dacă AlP intră în contact cu apa, acesta reacționează și formează fosfină sau fosfan PH3 care este extrem de inflamabil deoarece se aprinde în contact cu aerul. Prin urmare, poate exploda. În plus, fosfina provoacă moartea oamenilor și a animalelor.
Deoarece fosfura de aluminiu este un pesticid ieftin, utilizarea sa este o cauză comună de otrăvire la oameni și prezintă o rată ridicată a mortalității.

Reacționează cu umiditatea membranelor mucoase și cu acidul clorhidric HCl din stomac, formând gazul fosfan foarte toxic PH3. Prin urmare, prin inhalare și prin ingestie, se formează fosfină în organism, cu efecte fatale..
Ingerarea acestuia provoacă sângerări ale tractului gastro-intestinal, colaps cardiovascular, tulburări neuropsihiatrice, insuficiență respiratorie și renală în câteva ore..
AlP este foarte toxic pentru toate animalele terestre și acvatice.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Fosfură de aluminiu. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. și colab. (2007). Aluminiu. Alți compuși de aluminiu. În Manualul privind toxicologia metalelor (ediția a treia). Recuperat de la sciencedirect.com.
- Gupta, R.C. și Crissman, J.W. (2013). Evaluarea siguranței, inclusiv problemele actuale și emergente în patologia toxicologică. Risc uman. În Manualul de patologie toxicologică al lui Haschek și Rousseaux (ediția a treia). Recuperat de la sciencedirect.com.
- Alb, W.E. și Bushey, A.H. (1944). Fosfură de aluminiu - Preparare și compoziție. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Recuperat de la pubs.acs.org.
- Mirzaei, Maryam și Mirzaei, Mahmoud. (2011). Un studiu teoretic al nanotuburilor de fosfură de aluminiu dopate cu bor. Chimie computațională și teoretică 963 (2011) 294-297. Recuperat de la sciencedirect.com.
- Takahashi, L. și Takahashi, K. (2018). Reglarea structurii electronice a unui nanotub de fosfură de aluminiu prin configurarea geometriei rețelei. ACS Appl. Nano Mater. 2018, 1, 501-504. Recuperat de la pubs.acs.org.
- Gupta, P.K. (2016). Efectele toxice ale pesticidelor (agrochimice). Fosfură de aluminiu. În Fundamentele toxicologiei. Recuperat de la sciencedirect.com.


Nimeni nu a comentat acest articol încă.