
Formula moleculară cum se obține, exemple și exerciții
formulă moleculară Este o reprezentare a unei molecule a unui compus, în care atomii tuturor elementelor prezente în compus și numărul lor sunt indicați prin simbolurile lor chimice. Fiecare atom este însoțit de un indice.
Formula moleculară are limitarea că nu indică legăturile diferiților atomi ai moleculei și nici relația lor spațială; ca și formula structurală. În unele cazuri, nu este specific, de exemplu: C6H12SAU6 este formula moleculară a glucozei, galactozei și fructozei.
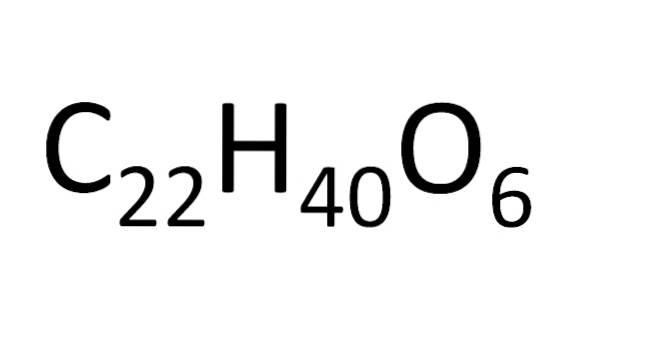
Există un set de reguli pentru aranjarea atomilor într-o formulă moleculară. Pentru sărurile ionice, de exemplu clorura de sodiu, simbolul cationic (Na+) și apoi simbolul anionic (Cl-). Acesta este motivul pentru care formula moleculară a clorurii de sodiu este NaCl.
Formula moleculară a compușilor organici este scrisă plasând mai întâi simbolul pentru carbon (C), urmat de simbolul pentru hidrogen (H) și apoi restul de atomi. De exemplu, formula moleculară a acidului acetic este CDouăH4SAUDouă.
Indice articol
- 1 Cum se obține formula moleculară
- 1.1 Primul pas
- 1.2 Al doilea pas
- 1.3 Al treilea pas
- 1.4 Al patrulea pas
- 1.5 Al cincilea pas
- 2 Exemple de formule moleculare
- 3 exerciții rezolvate
- 3.1 - Exercițiul 1
- 3.2 - Exercițiul 2
- 4 Referințe
Cum se obține formula moleculară
Obținerea formulei moleculare a unui compus se bazează pe stabilirea prealabilă a formulei sale minime sau empirice. Din acest motiv, pașii inițiali în obținerea ambelor formule sunt comune..
Primul pas
Este obișnuit să se exprime masa elementelor unui compus chimic într-o formă procentuală. Apoi trebuie efectuat un calcul simplu pentru a transforma procentele de masă ale diferitelor elemente în masele lor exprimate în grame..
Al doilea pas
Cunoscând masa în gram a fiecărui element și masa atomică a acestora, numărul relativ al fiecărui atom sau numărul de moli al fiecărui atom poate fi obținut prin împărțirea masei fiecăruia dintre diferitele elemente la masa lor atomică..
Al treilea pas
Împarte numerele relative ale toata lumea atomii, introduceți numărul relativ de valoare mai mică. Valorile proporției minime trebuie să fie numere întregi. În cazul în care o valoare a proporției conține o zecimală, trebuie făcută o corecție pentru ca această zecimală să dispară.
Corecția constă în înmulțirea tuturor valorilor proporției cu un număr care returnează numerele întregi la toate valorile. De exemplu, dacă o valoare a proporției minime este 1,25, toate valorile trebuie înmulțite cu patru (4). Din moment ce 1,25 ori 4 este egal cu 5, un număr întreg.
Al patrulea pas
Toate simbolurile chimice ale elementelor compusului vor fi plasate și cu indicele lor corespunzător; adică valoarea proporției minime a elementului.
Al cincilea pas
Formula minimă a unui compus poate fi transformată în formula sa moleculară prin obținerea raportului dintre greutatea moleculară a compusului și greutatea formulei sale minime (n). Această relație este aceeași care există între formula moleculară și formula minimă.
n = greutatea moleculară a compusului / greutatea cu formula minimă
Pentru a obține formula moleculară, formula minimă trebuie înmulțită cu n. Acest lucru implică faptul că fiecare dintre indicii cu formula minimă trebuie înmulțit cu n.
n = Greutate moleculară / Greutate minimă de formulă
= Formula moleculară / Formula minimă
Formula moleculară = formula minimă
Exemple de formule moleculare
Unele formule moleculare comune sunt enumerate mai jos:
-Oxid feros (FeO)
-Hidroxid de sodiu (NaOH)
-Oxid de potasiu (KDouăSAU)
-Oxid percloric (ClDouăSAU7)
-Hidroxid feric [Fe (OH)3]
-Clorură de calciu (CaClDouă)
-Acid clorhidric (HCI)
-Sulfat de sodiu (NDouăSW4)
-Acid sulfuric (HDouăSW4)
-Acid perbromic (HBrO4)
-Clorură de aluminiu (AlCl3)
-Metan (CH4)
-Propan (C3H8)
-Etan (CDouăH6)
-Alcool etilic (CDouăH6SAU)
-Acid acetic (CDouăH4SAUDouă)
-Benzen (C6H6)
-Glucoza (C6H12SAU6)
Exerciții rezolvate
- Exercitiul 1
Benzoatul de metil are următoarele procente de masă:
C: 70,57%,
H: 5,93%
Sau: 23,49%
Și o greutate moleculară de 136,1 g / mol. Determinați formula moleculară.
Primul pas
Primul pas este de a exprima procentele de masă ale elementelor din masele lor în grame, știind că procentele de masă sunt în raport cu greutatea moleculară..
Din cele 136,1 grame corespunzătoare molului compusului, 70,57% reprezintă doar carbon. Și așa mai departe cu elementele rămase:
Masă de carbon = 136,1 g (70,57 / 100)
= 96,05 g
Masa hidrogenului = 136,1 g (5,93 / 100)
= 8,06 g
Masa de oxigen = 136,1 (23,49 / 100)
= 31,96 g
Al doilea pas
În elaborarea formulei moleculare, trebuie determinat numărul relativ de atomi (NRA). Pentru a face acest lucru, masele elementelor sunt împărțite la masele lor atomice:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Al treilea pas
Apoi trebuie să calculăm proporțiile minime ale elementelor (PME). Pentru a face acest lucru, toate valorile NRA sunt împărțite la cea mai mică valoare NRA:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Al patrulea pas
Scrieți formula minimă pentru benzoatul de metil, pe baza faptului că indicii elementelor sunt proporțiile lor minime calculate:
C4H4SAU
Al cincilea pas
În cele din urmă, trebuie stabilită formula moleculară a benzoatului de metil. Prin urmare, calculăm n:
n = greutate moleculară / greutatea formulă minimă
Greutatea formulei minime este de 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Formula moleculară = 2 formula minimă
= 2 C4H4SAU
Formula moleculară de benzoat de metil = C8H8SAUDouă
- Exercițiul 2
Procentele elementelor care alcătuiesc benzenul sunt următoarele:
C: 92,36%
H: 7,64%.
Greutatea moleculară a benzenului este de 78 g / mol. Determinați-vă formula moleculară.
Primul pas
Transformați procentele de masă ale elementelor în masele lor în grame:
Masă de carbon = 78 g (92,36 / 100)
= 72,04 g
Masa hidrogenului = 78 g (7,64 / 100)
= 5,96 g
Al doilea pas
Calculul numărului relativ de atomi (NRA). Pentru a face acest lucru, masele elementelor sunt împărțite la masele lor atomice:
NRA (C) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Al treilea pas
Calculul valorilor proporției minime a elementelor (PME). Aceasta se calculează împărțind valorile NRA ale tuturor articolelor la cea mai mică valoare NRA:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Al patrulea pas
Scrierea formulei minime pentru benzen, ținând cont că indicii elementelor sunt valorile proporției minime calculate.
Formula minima de benzen: CH
Al cincilea pas
Stabilirea formulei moleculare prin calcularea relației dintre masa moleculară și masa formulei minime:
n = Greutate moleculară / Greutatea formulei minime
= 78 g / 13 g
n = 6
Formula moleculară = formula minimă
= 6CH
= C6H6
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2020). Formula chimica. Recuperat de pe: en.wikipedia.org
- Învățare fără limite. (s.f.). Formule moleculare. Recuperat de la: courses.lumenlearning.com
- Helmenstine, Anne Marie, dr. (29 septembrie 2019). Calculați formule empirice și moleculare. Recuperat de pe: thoughtco.com
- Peter J. Mikulecky, Chris Hren. (2020). Cum se utilizează formule empirice pentru a găsi formule moleculare. Recuperat de pe: dummies.com



Nimeni nu a comentat acest articol încă.