
Forța de coeziune

Ce sunt forțele de coeziune?
forțe de coeziune sunt forțele intermoleculare de atracție care țin moleculele împreună. În funcție de intensitatea forțelor de coeziune, o substanță se află într-o stare solidă, lichidă sau gazoasă. Valoarea forțelor de coeziune este o proprietate intrinsecă a fiecărei substanțe.
Această proprietate este legată de forma și structura moleculelor fiecărei substanțe. O caracteristică importantă a forțelor de coeziune este că acestea scad rapid odată cu creșterea distanței. Apoi, forțele de coeziune sunt numite forțele de atracție care apar între moleculele aceleiași substanțe.
forțe respingătoare sunt cele care rezultă din energia cinetică (energia datorată mișcării) particulelor. Această energie face ca moleculele să fie în continuă mișcare. Intensitatea acestei mișcări este direct proporțională cu temperatura la care se găsește substanța..
Pentru a provoca schimbarea stării unei substanțe, este necesar să-i creștem temperatura prin transmiterea căldurii. Acest lucru determină creșterea forțelor respingătoare ale substanței, care, în caz, poate ajunge să presupună că are loc schimbarea de stare..
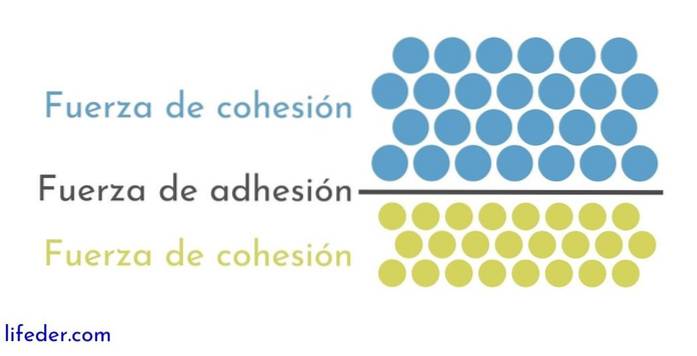
Pe de altă parte, este important și necesar să se facă distincția între coeziune și aderență:
- Coeziunea se datorează forțelor de atracție care apar între particulele adiacente ale aceleiași substanțe.
- Aderența este rezultatul interacțiunii care are loc între suprafețele diferitelor substanțe sau corpuri.
Aceste două forțe apar legate de diverse fenomene fizice care afectează lichidele, deci este importantă o bună înțelegere a ambelor..
Forțe de coeziune în solide, lichide și gaze

În solide
În general, în solide forțele de coeziune sunt foarte mari și apar intens în cele trei direcții ale spațiului..
În acest fel, dacă o forță externă este aplicată unui corp solid, au loc doar mici deplasări ale moleculelor una față de cealaltă..
Mai mult, atunci când forța externă dispare, forțele de coeziune sunt suficient de puternice pentru a readuce moleculele în poziția lor inițială, recuperând poziția înainte de aplicarea forței..
În lichide
Dimpotrivă, în lichide forțele de coeziune sunt mari doar în două dintre direcțiile spațiale, în timp ce sunt foarte slabe între straturile fluide..
Astfel, atunci când o forță este aplicată într-o direcție tangențială pe un lichid, această forță rupe legăturile slabe dintre straturi. Acest lucru face ca straturile lichidului să alunece unul peste altul..
Mai târziu, când se termină aplicarea forței, forțele de coeziune nu au suficientă forță pentru a readuce moleculele lichidului în poziția lor inițială..
În plus, coeziunea în lichide se reflectă și în tensiunea superficială, cauzată de o forță dezechilibrată îndreptată spre interiorul lichidului, acționând asupra moleculelor de suprafață..
La fel, coeziunea este observată și atunci când are loc tranziția de la starea lichidă la starea solidă, datorită efectului comprimării moleculelor lichidului..
În gaze
În gaze, forțele de coeziune sunt neglijabile. În acest fel, moleculele de gaz sunt în mișcare constantă, deoarece în cazul lor forțele de coeziune sunt incapabile să le mențină legate între ele..
Din acest motiv, în gaze forțele de coeziune pot fi apreciate numai atunci când are loc procesul de lichefiere, care are loc atunci când moleculele gazoase sunt comprimate și forțele de atracție sunt suficient de puternice pentru a produce tranziția stării..
Exemple de forțe de coeziune
Forțele coezive se combină adesea cu forțele de aderență pentru a da naștere anumitor fenomene fizice și chimice.
De exemplu, forțele de coeziune împreună cu forțele de aderență explică unele dintre cele mai frecvente fenomene care apar în lichide; este cazul meniscului, tensiunii superficiale și capilarității.
Prin urmare, în cazul lichidelor, este necesar să se facă distincția între forțele de coeziune, care apar între moleculele aceluiași lichid; și cele de aderență, care apar între moleculele lichidului și solidului.
Tensiune de suprafata

Tensiunea superficială este forța care apare tangențial și pe unitate de lungime la marginea suprafeței libere a unui lichid care se află în echilibru. Această forță contractă suprafața lichidului.
În cele din urmă, tensiunea superficială apare deoarece forțele din moleculele lichidului sunt diferite la suprafața lichidului decât cele din interior..
Menisc
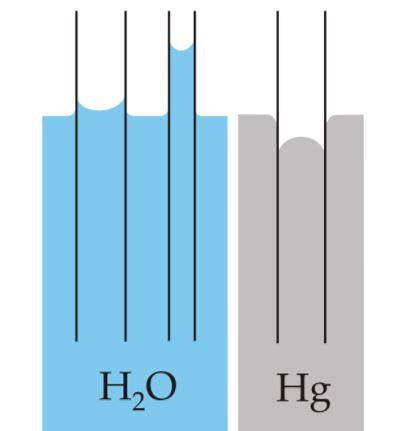
Meniscul este curbura care se creează pe suprafața lichidelor atunci când acestea sunt închise într-un recipient. Această curbă este produsă de efectul pe care îl are suprafața recipientului care îl conține asupra lichidului..
Curba poate fi convexă sau concavă, în funcție de faptul dacă forța dintre moleculele lichidului și cele ale recipientului este atractivă - cum este cazul apei și sticlei - sau este respingătoare, așa cum se întâmplă între mercur și sticlă..
Capilaritate

Capilaritatea este o proprietate a fluidelor care le permite să urce sau să coboare printr-un tub capilar. Este proprietatea care permite, parțial, creșterea apei în interiorul plantelor.
Un lichid crește tubul capilar atunci când forțele de coeziune sunt mai mici decât cele de aderență între lichid și pereții tubului. În acest fel, lichidul va continua să crească până când valoarea tensiunii superficiale este egală cu greutatea lichidului conținut în tubul capilar..
Dimpotrivă, dacă forțele de coeziune sunt mai mari decât forțele de aderență, tensiunea superficială va reduce lichidul și forma suprafeței sale va fi convexă..
Referințe
- Coeziune (chimie) (n.d.). În Wikipedia. Recuperat de pe en.wikipedia.org.
- Tensiunea superficială (n.d.). În Wikipedia. Recuperat de pe en.wikipedia.org.
- Capilaritate (n.d.). În Wikipedia. Recuperat de pe es.wikipedia.org.
- Ira N. Levine; Volumul 1 „Fizico-chimie”; Ediția a cincea; 2004; Mc Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chimie: Știința moleculară. Belmont, CA: Brooks / Cole.
- White, Harvey E. (1948). Fizica Colegiului Modern. van Nostrand.

Nimeni nu a comentat acest articol încă.