
Proprietăți de gaze, comportament, formă, exemple

gaze Sunt toate acele substanțe sau compuși ale căror stări de agregare sunt slabe și dispersate, în același timp în care depind foarte mult de condițiile de presiune și temperatură care le guvernează. Ele sunt probabil a doua cea mai abundentă formă de materie din întregul Univers după plasmă..
Pe Pământ, gazele alcătuiesc straturile atmosferei, de la exosferă la troposferă și aerul pe care îl respirăm. Deși un gaz este invizibil atunci când este difuzat prin spații mari, precum cerul, este detectat de mișcarea norilor, de rotațiile lamelor unei mori sau de vaporii expirați din gura noastră în climă rece..

De asemenea, mergând la aspectele negative de mediu, se observă în fumul negru de la conductele de evacuare ale vehiculelor, în coloanele de fum ale turnurilor amplasate în fabrici sau în fumul ridicat când arde o pădure.
De asemenea, vă confruntați cu fenomene gazoase atunci când vedeți vapori care ies din canalizare, în pâlcurile mlaștinilor și cimitirelor, în clocotirea din rezervoarele de pești, în baloanele de heliu care sunt eliberate în cer, în oxigenul eliberat de plante ca urmare a fotosintezei lor și chiar în eructații și flatulențe.
Oriunde se observă gaze înseamnă că a avut loc o reacție chimică, cu excepția cazului în care sunt fixate sau asimilate direct din aer, principala sursă de gaze (superficial) de pe planetă. Pe măsură ce temperaturile cresc, toate substanțele (elementele chimice) se vor transforma în gaze, inclusiv metale precum fierul, aurul și argintul..
Indiferent de natura chimică a gazelor, toate împărtășesc în comun distanța mare care le separă particulele (atomi, molecule, ioni etc.), care se mișcă haotic și arbitrar printr-un volum sau spațiu dat..
Indice articol
- 1 Proprietățile gazelor
- 1.1 Fizic
- 1.2 Conductivitatea electrică și termică
- 1.3 Reactivitate
- 2 Comportamentul gazelor
- 3 Forma gazelor
- 4 Presiunea unui gaz
- 4.1 Unități
- 5 Volumul unui gaz
- 6 Principalele legi privind gazele
- 6.1 Legea lui Boyle
- 6.2 Legea lui Charles
- 6.3 Legea lui Gay-Lussac
- 6.4 Legea lui Avogadro
- 7 Tipuri de gaze
- 7.1 Gazele combustibile
- 7.2 Gazele industriale
- 7.3 Gazele inerte
- 8 Exemple de elemente și compuși gazoși
- 8.1 Compuși gazoși
- 9 Referințe
Proprietățile gazelor
Fizic
Proprietățile fizice ale gazelor variază în funcție de substanța sau compusul implicat. Gazele sunt asociate în mod popular cu mirosuri proaste sau putrefacție, fie datorită conținutului lor de sulf, fie datorită prezenței aminelor volatile. La fel, acestea sunt vizualizate cu colorații verzui, maro sau gălbui, care intimidează și dau un rău augur.
Cu toate acestea, majoritatea gazelor, sau cel puțin cele mai abundente, sunt de fapt incolore și inodore. Deși sunt evazive, pot fi resimțite pe piele și rezistă mișcării, creând chiar straturi vâscoase pe corpurile care trec prin ele (așa cum se întâmplă cu avioanele)..
Toate gazele pot suferi modificări de presiune sau temperatură care ajung să le transforme în lichidele lor respective; adică suferă condens (dacă sunt răcite) sau lichefiere (dacă sunt „presate”).

Pe de altă parte, gazele sunt capabile să se dizolve în lichide și în unele solide poroase (cum ar fi cărbunele activ). Bulele sunt rezultatul acumulărilor de gaze care nu s-au dizolvat încă în mediu și scapă către suprafața lichidului..
Conductivitate electrică și termică
În condiții normale (fără ionizarea particulelor lor), gazele sunt conductori slabi ai căldurii și electricității. Cu toate acestea, când sunt stresați cu mulți electroni, permit curentului să treacă prin ei, așa cum se vede în fulgere în timpul furtunilor..
Pe de altă parte, la presiuni scăzute și supuse unui câmp electric, unele gaze, în special cele nobile sau perfecte, se aprind și luminile lor sunt utilizate pentru proiectarea de reclame și afișe de noapte (lumină neon), precum și în celebre lămpi cu descărcare electrică în felinarele stradale.
În ceea ce privește conductivitatea termică, multe gaze se comportă ca izolatoare termice, astfel încorporarea lor în umplerea fibrelor, țesăturilor sau panourilor de sticlă, ajută la prevenirea trecerii căldurii prin ele și menține temperatura constantă..
Cu toate acestea, există gaze care sunt bune conductoare de căldură și pot provoca arsuri mai grave decât cele cauzate de lichide sau solide; de exemplu, ca și în cazul aburului fierbinte de la cupcakes (sau empanadas) sau a jeturilor de abur care scapă din cazane.
Reactivitate
În general, reacțiile care implică gaze sau acolo unde apar, sunt clasificate ca fiind periculoase și greoaie.
Reactivitatea lor depinde, din nou, de natura lor chimică; Cu toate acestea, atunci când se extinde și se mobilizează cu mare ușurință, trebuie exercitată o mai mare grijă și control, deoarece acestea pot declanșa creșteri drastice ale presiunii care pun în pericol structura reactorului; ca să nu mai vorbim de cât de inflamabile sau nu sunt gazele fericite.
Comportamentul gazelor
Macroscopic se poate face o idee despre comportamentul gazelor, asistând la modul în care fumul, inelele sau „limbile” literare ale țigărilor evoluează în aer. La fel, când explodează o grenadă de fum, este interesant să detaliați mișcarea acestor nori de diferite culori.
Cu toate acestea, astfel de observații sunt supuse acțiunii aerului și, de asemenea, faptului că există particule solide foarte fine suspendate în fum. Prin urmare, aceste exemple nu sunt suficiente pentru a ajunge la o concluzie cu privire la adevăratul comportament al unui gaz. În schimb, s-au efectuat experimente și s-a dezvoltat teoria cinetică a gazelor..
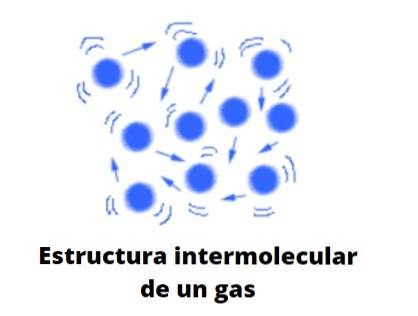
Molecular și ideal, particulele gazoase se ciocnesc elastic una cu cealaltă, având deplasări liniare, de rotație și vibraționale. Au o energie medie asociată, care le permite să călătorească liber prin orice spațiu fără a interacționa sau a ciocni aproape cu o altă particulă pe măsură ce volumul din jurul lor crește..
Comportamentul său va deveni un amestec al mișcării browniene neregulate și a ciocnirilor unor bile de biliard care sar fără încetare între ele și pereții mesei; dacă nu există pereți, aceștia se vor difuza spre infinit, cu excepția cazului în care sunt reținuți de o forță: gravitația.
Forma gazelor
Gazele, spre deosebire de lichide și solide, nu sunt de tip condensat; adică agregarea sau coeziunea particulelor sale nu reușește niciodată să definească o formă. Împărtășesc cu lichidele faptul că ocupă complet volumul recipientului care le conține; cu toate acestea, le lipsește tensiunea superficială și superficială.
Dacă concentrația gazului este mare, „limbile” acestuia sau formele macroscopice deja descrise pot fi văzute cu ochiul liber. Acestea, mai devreme sau mai târziu, vor ajunge să dispară prin acțiunea vântului sau prin simpla expansiune a gazului. Prin urmare, gazele acoperă toate colțurile spațiului limitat, originând sisteme foarte omogene.
Acum, teoria consideră convenabil gazele ca sfere care se ciocnesc cu greu; dar atunci când o fac, sări elastic.
Aceste sfere sunt larg separate între ele, astfel încât gazele sunt practic „pline” de vid; de aici versatilitatea sa de a trece prin cea mai mică fantă sau fisură și ușurința de a le putea comprima semnificativ.
De aceea, oricât de închisă ar fi o instalație de panificație, dacă te plimbi lângă ea este sigur că te vei bucura de aroma pâinii proaspăt coapte..
Presiunea unui gaz
S-ar putea crede că, deoarece sferele sau particulele de gaz sunt atât de dispersate și separate, sunt incapabile să genereze presiune asupra corpurilor sau obiectelor. Cu toate acestea, atmosfera demonstrează că o astfel de credință este falsă: are masă, greutate și împiedică evaporarea sau fierberea lichidelor de nicăieri. Punctele de fierbere sunt măsurate la presiunea atmosferică.
Presiunile de gaz devin mai mult cuantificabile dacă sunt disponibile manometre sau dacă sunt închise în containere cu pereți nedeformabili. Astfel, cu cât sunt mai multe particule de gaz în interiorul containerului, cu atât este mai mare numărul de coliziuni dintre acestea și pereții containerului..
Aceste particule, atunci când se ciocnesc cu pereții, le presează, deoarece exercită o forță proporțională cu energia lor cinetică pe suprafața lor. Este ca și cum bilele de biliard ideale aruncați pe un perete; dacă sunt mulți care le afectează la viteză mare, s-ar putea chiar rupe.
Unități
Există multe unități care însoțesc măsurătorile presiunii gazului. Unele dintre cele mai cunoscute sunt milimetri de mercur (mmHg), cum ar fi torr. Există cele ale sistemului internațional de unități (SI) care definesc pascalul (Pa) în termeni de N / mDouă; și din el, kilo (kPa), mega (MPa) și giga (GPa) pascal.
Volumul unui gaz
Un gaz ocupă și se extinde pe tot volumul containerului. Cu cât containerul este mai mare, volumul gazului va fi prea mare; dar atât presiunea cât și densitatea acestuia vor scădea pentru aceeași cantitate de particule.
Gazul în sine, pe de altă parte, are un volum asociat care nu depinde atât de mult de natura sau structura sa moleculară (în mod ideal), ci de condițiile de presiune și temperatură care îl guvernează; acesta este volumul său molar.
În realitate, volumul molar variază de la un gaz la altul, deși variațiile sunt mici dacă nu sunt molecule mari și eterogene. De exemplu, volumul molar de amoniac (NH3, 22,079 L / mol) la 0 ° C și 1 atm, diferă de heliu (He, 22,435 L / mol).
Toate gazele au un volum molar care se schimbă în funcție de P și T și, indiferent cât de mari sunt particulele lor, numărul acestora este întotdeauna același. De aici, de fapt, el a derivat ceea ce este cunoscut sub numărul lui Avogadro (NLA).
Principalele legi privind gazele
Comportamentul gazelor a fost studiat timp de secole prin experimente, observații aprofundate și interpretarea rezultatelor..
Astfel de experimente au făcut posibilă stabilirea unei serii de legi care, reunite în aceeași ecuație (cea a gazelor ideale), ajută la prezicerea răspunsurilor unui gaz la diferite condiții de presiune și temperatură. În acest fel, există o relație între volumul, temperatura și presiunea acestuia, precum și numărul de aluniți ai acestuia într-un sistem dat..
Printre aceste legi se numără următoarele patru: Boyle, Charles, Gay-Lussac și Avogadro's.
Legea lui Boyle
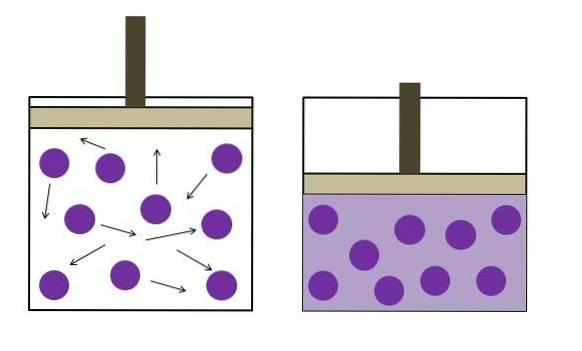
Legea lui Boyle afirmă că la temperatura constantă, volumul unui gaz ideal este invers proporțional cu presiunea acestuia; adică, cu cât containerul este mai mare, cu atât este mai mică presiunea pe care o vor experimenta pereții săi din cauza aceleiași cantități de gaz..
Charles Law

Legea lui Charles afirmă că, la presiune constantă, volumul unui gaz ideal este direct proporțional cu temperatura acestuia. Baloanele demonstrează legea lui Charles, deoarece, dacă sunt încălzite, se umflă puțin mai mult, în timp ce, dacă sunt scufundate în azot lichid, se dezumflă, deoarece volumul gazului din interior se contractă..
Legea Gay-Lussac
Legea lui Gay-Lussac afirmă că, la volum constant, presiunea unui gaz ideal este direct proporțională cu temperatura acestuia. Într-un cazan bine închis, dacă un gaz este încălzit progresiv, de fiecare dată presiunea din interior va fi mai mare, deoarece pereții cazanului nu se deformează sau se extind; adică volumul său nu se schimbă, este constant.
Legea lui Avogadro
În cele din urmă, legea lui Avogadro afirmă că volumul ocupat de un gaz ideal este direct proporțional cu numărul particulelor sale. Astfel, dacă avem un mol de particule (6.02 · 102. 3), vom avea apoi volumul molar al gazului.
Tipuri de gaze
Gazele combustibile
Sunt acele gaze ale căror componente funcționează ca combustibili, deoarece sunt utilizate pentru producerea de energie termică. Unele dintre acestea sunt gaz natural, gaz petrolier lichefiat și hidrogen.
Gazele industriale
Sunt acele gaze fabricate, care sunt comercializate publicului pentru diferite utilizări și aplicații, cum ar fi sănătatea, alimentele, protecția mediului, metalurgie, industria chimică, sectoarele securității, printre altele. Unele dintre aceste gaze sunt oxigen, azot, heliu, clor, hidrogen, monoxid de carbon, propan, metan, oxid azotat, printre altele..
Gazele inerte
Sunt acele gaze care, în condiții specifice de temperatură și presiune, nu generează nicio reacție chimică sau una foarte scăzută. Sunt neon, argon, heliu, kripton și xenon. Sunt utilizate în procese chimice în care sunt necesare elemente non-reactive.
Exemple de elemente și compuși gazoși
Care sunt elementele gazoase ale tabelului periodic în condiții de pământ?
Mai întâi avem hidrogen (H), care formează molecule de HDouă. Urmează Heliu (He), cel mai ușor gaz nobil; și apoi azot (N), oxigen (O) și fluor (F). Aceste ultime trei formează și molecule diatomice: NDouă, SAUDouă și FDouă.
După fluor vine neonul (Ne), gazul nobil care urmează heliului. Sub fluor avem clor (Cl), sub formă de molecule de ClDouă.
Apoi avem restul gazelor nobile: argon (Ar), kripton (Kr), xenon (Xe), radon (Rn) și oganeson (Og).
Prin urmare, acestea sunt în total douăsprezece elemente gazoase; unsprezece dacă excludem oganesonul extrem de radioactiv și instabil.
Compuși gazoși
Pe lângă elementele gazoase, vor fi enumerați și câțiva compuși gazoși obișnuiți:
-HDouăDa, hidrogen sulfurat, responsabil pentru mirosul ouălor putrede
-NH3, amoniac, acea aromă înțepătoare găsită în săpunurile uzate
-CODouă, dioxid de carbon, un gaz cu efect de seră
-NUDouă, dioxid de azot
-NU, monoxid de azot, un gaz despre care se credea că este foarte toxic, dar joacă un rol important în sistemul circulator
-SW3, trioxid de sulf
-C4H10, butan
-HCI, clorură de hidrogen
-SAU3, ozon
-SF6, hexafluorură de sulf
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Proprietățile gazelor. Recuperat de la: chemed.chem.purdue.edu
- Wikipedia. (2019). Gaz. Recuperat de pe: en.wikipedia.org
- Helmenstine, Anne Marie, dr. (5 decembrie 2018). Gazele - Proprietățile generale ale gazelor. Recuperat de pe: thoughtco.com
- Harvard Men's Health Watch. (2019). Starea gazului. Recuperat de pe: health.harvard.edu
- Editoare de răcire electronică. (1 septembrie 1998). Conductivitatea termică a gazelor. Recuperat de pe: electronics-cooling.com


Nimeni nu a comentat acest articol încă.