
Proprietăți cu halogenuri de alchil, preparare, exemple

halogenuri de alchil sunt compuși organici în care un atom de carbon cu hibridizare sp3 este legat covalent de un halogen (F, Cl, Br, I). Din altă perspectivă, este convenabil, să simplificăm, să presupunem că sunt haloalcani; aceștia sunt alcani la care unii atomi de H au fost înlocuiți cu atomi de halogen.
De asemenea, după cum indică și numele, atomii de halogen trebuie să fie legați de grupări alchil, R, pentru a fi considerați de acest tip de halogenură; deși, din punct de vedere structural, pot fi substituiți sau ramificați și au inele aromatice și rămân în continuare o halogenură de alchil.
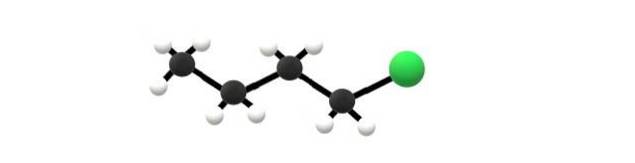
Deasupra este molecula de 1-clorobutan, care corespunde uneia dintre cele mai simple halogenuri de alchil. Se poate observa că toți carbonii săi au legături simple și, de asemenea, au hibridizare sp3. Prin urmare, sfera verde, corespunzătoare atomului de Cl, este legată de un schelet derivat din alcan butan.
Exemple chiar mai simple decât 1-clorobutanul sunt cele derivate din gazul metan: cea mai mică hidrocarbură dintre toate.
Din molecula sa de CH4 Atomii H pot fi înlocuiți cu, să zicem, iod. Dacă se substituie un H, vom avea CH3I (iodometan sau iodură de metil). Înlocuind două H, vom avea CHDouăEuDouă (diiodometan sau iodură de metilen). Apoi și în cele din urmă, eu înlocuiesc toate H-urile oferind CHI3 (iodoform) și CI4 (tetraiodură de carbon).
Halogenurile de alchil se caracterizează prin faptul că sunt foarte reactive și, având cei mai mulți atomi electronegativi din tabelul periodic, se intuiește că prin mecanisme fără sfârșit exercită o influență asupra matricelor biologice.
Indice articol
- 1 Proprietățile halogenurilor de alchil
- 1.1 Puncte de fierbere și topire
- 1.2 Polaritate
- 1.3 Puterea solventului
- 2 Nomenclatură
- 2.1 Exemplu
- 3 Obținerea
- 3.1 Halogenare cu lumină sau radiații ultraviolete
- 3.2 Adăugarea de hidrocizi sau halogeni la alchene
- 4 Reacții
- 4.1 Înlocuirea nucleofilă
- 4.2 Eliminarea
- 4.3 Sinteza reactivilor Grignard
- 5 Exemple
- 6 utilizări
- 6.1 Solvent
- 6.2 Sinteza organică
- 6.3 Industria farmaceutică
- 6.4 Agenți frigorifici
- 7 Referințe
Proprietățile halogenurilor de alchil
Proprietățile acestei familii de compuși depind de structurile lor moleculare. Cu toate acestea, în comparație cu cei ai alcanilor derivați, se pot observa diferențe notabile cauzate de simplul fapt de a avea legături C-X (X = atom de halogen).
Adică, legăturile C-X sunt responsabile pentru orice diferență sau similitudine între una sau mai multe halogenuri de alchil..
Pentru început, legăturile C-H sunt aproape apolare, având în vedere diferența mică de electronegativitate dintre C și H; pe de altă parte, legăturile C-X prezintă un moment dipol permanent, datorită faptului că halogenii sunt mai electronegativi decât carbonul (în special fluor).
Pe de altă parte, unii halogeni sunt ușori (F și Cl), în timp ce alții sunt grei (Br și I). Masele lor atomice modelează, de asemenea, diferențele în cadrul legăturilor C-X; și, la rândul său, direct asupra proprietăților halogenurii.
Prin urmare, adăugarea de halogeni la o hidrocarbură este egală cu creșterea polarității și a masei sale moleculare; echivalează cu a-l face mai puțin volatil (până la un punct), mai puțin inflamabil și a crește punctele de fierbere sau topire.
Puncte de fierbere și topire
Acestea fiind spuse mai sus, dimensiunea și, prin urmare, greutatea diferiților halogeni sunt prezentate în ordine crescătoare:
F < Cl < Br < I
Astfel, se poate aștepta ca halogenurile de alchil care conțin atomi F să fie mai ușoare decât cele care conțin atomi Br sau I..
De exemplu, unele halogenuri derivate din metan sunt considerate:
CH3F < CH3Cl < CH3Fr < CH3Eu
CHDouăFDouă < CHDouăClDouă < CHDouăFrDouă < CHDouăEuDouă
Și așa mai departe pentru celelalte produse derivate cu un grad mai ridicat de halogenare. Rețineți că ordinea este menținută: halogenurile de fluor sunt mai ușoare decât halogenurile de iod. Nu numai asta, ci și punctele lor de fierbere și topire respectă, de asemenea, această ordine; RF fierbe la temperaturi mai scăzute decât RI (R = CH3, pentru acest caz).
La fel, toate aceste lichide sunt incolore, deoarece electronii nu pot absorbi sau elibera fotoni în legăturile lor C-X pentru a tranzita alte niveluri de energie. Cu toate acestea, pe măsură ce devin mai grele, pot cristaliza și afișa culori (la fel ca iodoformul, CHI3).
Polaritate
Legăturile C-X diferă prin polaritate, dar în ordinea inversă ca mai sus:
C-F> C-Cl> C-Br> C-I
Prin urmare, legăturile C-F sunt mai polare decât legăturile C-I. Fiind mai polari, halogenurile RF tind să interacționeze prin forțe dipol-dipol. Între timp, în halogenurile RBr sau RI, momentele dipolice ale acestora sunt mai slabe și interacțiunile guvernate de forțele de dispersie din Londra capătă o forță mai mare..
Puterea solventului
Deoarece halogenurile de alchil sunt mai polare decât alcanii din care sunt derivați, își cresc capacitatea de a dizolva un număr mai mare de compuși organici. Din acest motiv, tind să fie solvenți mai buni; deși nu înseamnă că pot înlocui alcani în toate aplicațiile.
Există criterii tehnice, economice, ecologice și de performanță pentru a prefera un solvent halogenat în locul unui alcan.
Nomenclatură
Există două moduri de a denumi o halogenură de alchil: după numele său comun sau prin denumirea sa sistematică (IUPAC). Denumirile obișnuite sunt de obicei mai convenabile de utilizat atunci când RX este simplu:
CHCI3
Cloroform: nume comun
Triclorură de metil sau triclorometan: denumire IUPAC.
Dar numele sistematice sunt de preferat (și singura opțiune), atunci când aveți structuri ramificate. În mod ironic, numele comune sunt utile din nou atunci când structurile sunt prea complicate (cum ar fi cele care vor fi văzute în ultima secțiune).
Regulile pentru denumirea unui compus conform sistemului IUPAC sunt aceleași ca și pentru alcooli: se identifică lanțul principal, care este cel mai lung sau cel mai ramificat. Apoi, carbonii sunt enumerați începând de la capătul cel mai apropiat de substituenți sau ramuri, denumiți în ordine alfabetică.
Exemplu
Pentru a ilustra, avem următorul exemplu:
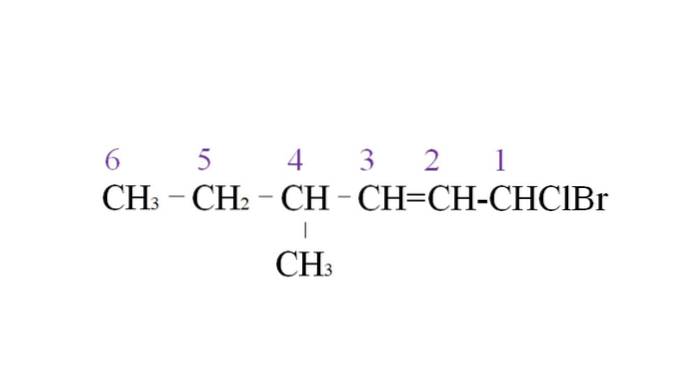
Prima ramură este gruparea metil la C-4; dar, întrucât există o dublă obligațiune, câștigă o prioritate mai mare față de regula menționată. Din acest motiv, cel mai lung lanț începe să fie listat din dreapta, condus de un atom de carbon legat de doi halogeni: Cl și Br.
Odată cu enumerarea, substituenții sunt denumiți în ordine alfabetică:
1-brom-1-clor-4-metil-2-hexenă.
Obținerea
Pentru a obține halogenurile de alchil, moleculele trebuie supuse unui proces de halogenare; adică încorporează atomi de halogen în structurile lor, în special un atom cu un carbon sp3.
Există două metode pentru a le obține sau sintetiza: prin radiații ultraviolete printr-un mecanism de radicali liberi sau prin adăugarea de hidrocizi sau halogeni..
Halogenare cu lumină sau radiații ultraviolete
Primul, cel mai puțin adecvat și cu cea mai slabă performanță, constă în iradierea alcanilor cu radiații ultraviolete (hv) în prezența unui halogen. De exemplu, sunt prezentate ecuațiile pentru clorarea metanului:
CH4 + ClDouă => CH3Cl + HCl (sub lumină UV)
CH3Cl + ClDouă => CHDouăClDouă + acid clorhidric
CHDouăClDouă + ClDouă => CHCI3 + acid clorhidric
CHCI3 + ClDouă => CCl4 + acid clorhidric
Cei patru compuși (CH3Cl, CHDouăClDouă, CHCI3 și CCl4) sunt formate și, prin urmare, aveți un amestec, care poate fi supus distilării fracționate. Cu toate acestea, această metodă este impracticabilă și se preferă recurgerea la sinteze organice..
Un alt exemplu este bromurarea n-hexanului:
CH3CHDouăCHDouăCHDouăCHDouăCH3 + FrDouă => CH3(Br) CHCHDouăCHDouăCHDouăCH3 + HBr
Din nou, în această reacție, radiația lumină sau ultravioletă este utilizată pentru a promova formarea radicalilor liberi. Bromul, deoarece este un lichid roșu intens, devine decolorat pe măsură ce reacționează, observând astfel o schimbare a culorii de la roșu la incolor atunci când se formează 2-bromohexan..
Adăugarea de hidrocizi sau halogeni la alchene
A doua metodă de obținere a halogenurilor de alchil constă în tratarea alcoolilor (ROH) sau a alchenelor (RDouăC = CRDouă) cu hidracizi. Hidracizii au formula generală HX (HF, HCl, HBr și HI). Un exemplu va fi prezentat folosind etanol pentru fiecare dintre ele:
CH3CHDouăOH + HF => CH3CHDouăF + HDouăSAU
CH3CHDouăOH + HCI => CH3CHDouăCl + HDouăSAU
CH3CHDouăOH + HBr => CH3CHDouăBr + HDouăSAU
CH3CHDouăOH + HI => CH3CHDouăI + HDouăSAU
La fel, alchenele pot adăuga molecule HX la legăturile lor duble, formând halogenuri de alchil secundare..
CHDouă= CH-CH3 + HBr => BrCHDouă-CHDouă-CH3 + CH3-CHBr-CH3
Produsul BrCHDouă-CHDouă-CH3 este 1-bromopropan și CH3-CHBr-CH3 2-bromopropan. Al doilea este produsul majoritar, deoarece este cel mai stabil, în timp ce primul este produs într-o măsură mai mică, deoarece este mai instabil. Acest lucru se datorează faptului că CH3CHBrCH3 este o halogenură de alchil secundară.
Foarte similar se întâmplă atunci când ceea ce se adaugă la alchenă este o moleculă de XDouă:
CHDouă= CH-CH3 + FrDouă => BrCHDouă-CHBr-CH3
Cu toate acestea, se obține o halogenură de alchil cu doi atomi de brom legați de carboni adiacenți; halogenură de alchil vicinală. Dacă, pe de altă parte, ați avea cei doi bromi atașați la același carbon, ați avea o halogenură de alchil geminală, precum următoarele:
FrDouăCH-CHDouă-CH3
Reacții
Substituție nucleofilă
Reactivitățile halogenurilor de alchil se bazează pe fragilitatea sau rezistența legăturii C-X. Cu cât halogenul este mai greu, cu atât este mai slabă legătura și, prin urmare, cu atât mai ușor se va sparge. Într-o reacție chimică, legăturile se rup și se formează altele noi; Legăturile C-X sunt rupte, pentru a forma o legătură C-G (G = grup nou).
În termeni mai adecvați, X acționează ca un grup care pleacă, iar G ca un grup care intră într-o reacție de substituție nucleofilă. De ce apare această reacție? Deoarece X, fiind mai electronegativ decât carbonul, „fură” densitatea electronilor, lăsându-i un deficit de electroni care se traduce ca o sarcină parțială pozitivă:
Cδ+-Xδ-
Dacă o specie negativă (: G-) sau neutru cu o pereche de electroni disponibilă (: G), capabilă să formeze o legătură C-G mai stabilă, X va ajunge să fie înlocuit cu G. Cele de mai sus pot fi reprezentate de următoarea ecuație chimică:
RX +: G- => RG + X-
Cu cât legătura C-X sau R-X este mai slabă, cu atât reactivitatea sau tendința de a fi înlocuită cu agent nucleofil (sau nucleofil) G; adică iubitorii de nuclee sau sarcini pozitive.
Exemple
O serie de ecuații generale pentru substituțiile nucleofile pe care le pot suferi halogenurile de alchil este prezentată mai jos:
RX + OH- => ROH + X- (Alcooli)
+ SAU'- => ROR' (Ethers, sinteza Williamson)
+ Eu- => RI (ioduri de alchil)
+ CN- => RCN (azoti)
+ R'COO- => RCOOR '(Esteri)
+ NH3 => RNHDouă (Amine)
+ P (C6H5)3 => RP (C6H5)3+ X- (Săruri de fosfoniu)
+ SH- => RSH (Tioli)
Din aceste exemple se poate suspecta deja cât de valoroase sunt halogenurile de alchil pentru sinteze organice. Una dintre numeroasele înlocuiri care au rămas de citat este cea a reacției Friedel Crafts, folosită pentru a „închiria” inele aromatice:
RX + ArH + AlCl3 => ArR
În această reacție, un H al inelului aromatic este înlocuit cu o grupare R din RX.
Eliminare
Halogenurile de alchil pot elibera molecule HX printr-o reacție de eliminare; în mod specific, o dehidrohalogenare:
RDouăCH-CXRDouă + Oh- => RDouăC = CRDouă + HX
Se spune că dehidrohalogenarea are loc deoarece atât un H cât și un X se pierd în aceeași moleculă HX.
Sinteza reactivilor Grignard
Halogenurile de alchil pot reacționa cu anumite metale pentru a forma reactivul Grignard, folosit pentru a adăuga grupări R la alte molecule. Ecuația generală pentru sinteza sa este următoarea:
RX + Mg => RMgX
Exemple
Diferite exemple de halogenuri de alchil au fost deja menționate pe parcursul secțiunilor. Unele altele, simple, sunt:
-Clorură de etil, CH3CHDouăCl
-Fluorură de izopropil, (CH3)DouăCHDouăF
-2-metil-3-cloropentan, CH3-CH (CH3) -CHCl-CHDouăCH3
-iodură de sec-butil, CH3CHDouăCHDouăI-CH3
-3-bromo-6-iodoheptan, CH3-CHDouă-CHBr-CHDouă-CHDouă-CHDouăEu
-3,4-dibromo-1-pentenă, CH3-CHBr-CHBr-CH = CHDouă
Aplicații
Solvent
În secțiunile anterioare, sa menționat capacitatea de solvent a halogenurilor de alchil. Industria a profitat de această proprietate pentru a le folosi ca produse de curățare, fie pentru materiale textile, componente electronice, fie pentru a îndepărta petele de lac..
De asemenea, sunt folosiți ca solvenți pentru vopsele sau ca probe organice sau grase pentru nenumărate tipuri de teste analitice..
Sinteza organică
Halogenurile de alchil sunt foarte utile pentru "alchilarea" inelelor aromatice, servind în același timp ca sursă de pornire pentru sinteza practic a tuturor celorlalte familii de compuși organici. Sintetic, RX este considerat o sursă de grupări sau lanțuri R, care poate fi dorită pentru încorporare în compuși foarte aromatici..
Industria farmaceutica
S-a menționat la început că atomii de halogen interacționează cu matricile biologice, astfel încât în organismele noastre nu pot trece neobservați fără a genera o schimbare, pozitivă sau negativă. Dacă un medicament exercită un efect pozitiv asupra corpului, având un atom de halogen, acest efect poate fi sau nu crescut.
Deci, dacă X este legat direct de un carbon sp-hibridizat3, va avea o halogenură de alchil și nu un derivat halogenat. Unele dintre astfel de halogenuri sunt prezentate mai jos în următoarea serie de imagini:
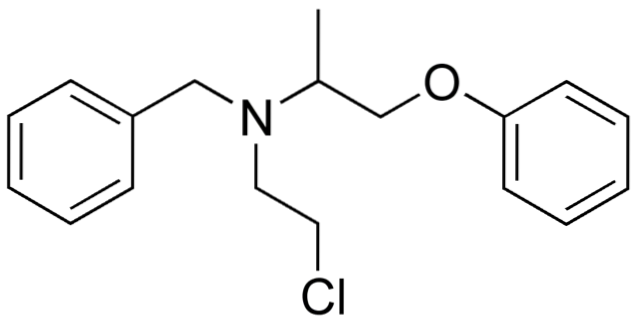
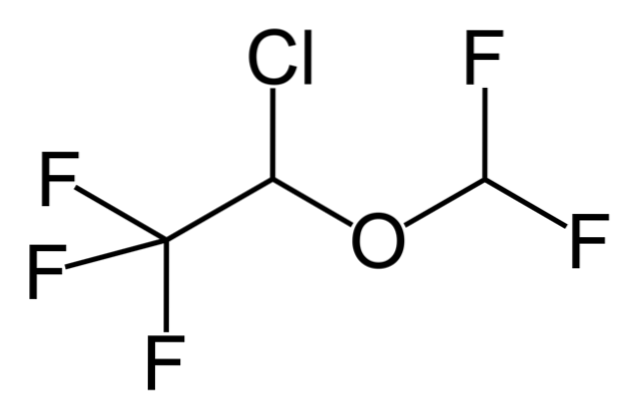

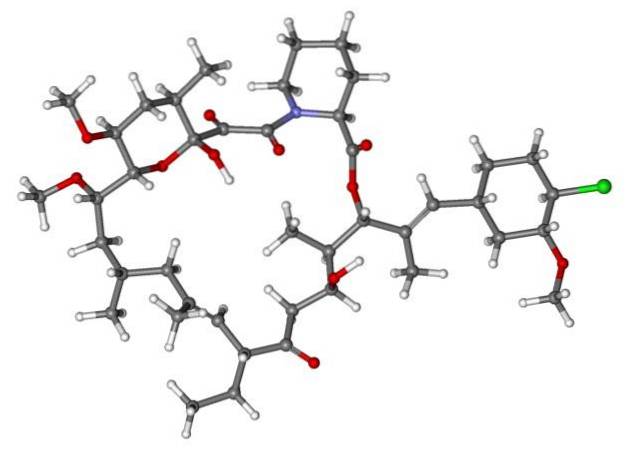

Rețineți că în aceste cinci medicamente există cel puțin o legătură de tip CHDouă-X sau CH-X; adică halogenul este atașat la un carbon sp3.
Agenti frigorifici
Celebrul agent frigorific Freon-12 (CHCIFDouă), la fel ca alți fluoroalcani sau hidrofluorocarburi, au înlocuit gazele de amoniac și clorofluorocarbonii (CFC) în această funcție deoarece, deși sunt substanțe nevolatile sau toxice, ele distrug stratul de ozon; în timp ce freonul-12, fiind mai reactiv, este distrus înainte de a atinge astfel de altitudini.
Referințe
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Clark Jim. (2016, 14 iulie). Utilizări de halogenuri de alchil. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Gál, B., Bucher, C. și Burns, N. Z. (2016). Halogenuri de alchil chirale: motive neexplorate în medicină. Droguri marine, 14 (11), 206. doi: 10.3390 / md14110206
- Halogenuri de alchil. Recuperat de la: chemed.chem.purdue.edu
- Patkar Prachi. (16 iulie 2017). Totul despre halogenuri de alchil: proprietăți, utilizări și multe altele. Știința lovită. Recuperat de pe: sciencestruck.com
- R. Nava. (2016). Halogenuri de alchil. Recuperat de la: hyperphysics.phy-astr.gsu.edu
- Ghid de învățare pentru capitolul 9 - Halogenuri de alchil I. Recuperat de la: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Halogenuri de alchil: proprietăți, utilizări și aplicații. [PDF. Recuperat de la: cvonline.uaeh.edu.mx



Nimeni nu a comentat acest articol încă.