
Istoria heliului, proprietăți, structură, riscuri, utilizări
heliu este un element chimic al cărui simbol este He. Este primul gaz nobil din tabelul periodic și, de obicei, este situat la extrema dreaptă a acestuia. În condiții normale, este un gaz inert, deoarece niciunul dintre puținii săi compuși nu este stabil; De asemenea, se extinde foarte rapid și este substanța cu cel mai scăzut punct de fierbere dintre toate.
La nivel popular, este un gaz bine cunoscut, deoarece în nenumărate evenimente sau petreceri pentru copii este obișnuit să asistăm la modul în care un balon se ridică până se pierde pe cer. Totuși, ceea ce se pierde cu adevărat și pentru totdeauna în colțurile sistemului solar și dincolo, sunt atomii de heliu care sunt eliberați odată cu explozia sau dezumflarea balonului..

De fapt, sunt cei care, și cu un motiv întemeiat, consideră că baloanele cu heliu reprezintă o practică inadecvată pentru acest gaz. Din fericire, are utilizări mai importante și mai interesante, datorită proprietăților sale fizice și chimice care îl separă de alte elemente chimice..
De exemplu, heliul lichid este atât de rece încât poate îngheța orice, ca un aliaj metalic, transformându-l într-un material supraconductor. La fel, este un lichid care manifestă superfluiditate, capabil să urce pe pereții unui recipient de sticlă..
Numele său se datorează faptului că a fost identificat pentru prima dată pe Soare și nu pe Pământ. Este al doilea cel mai abundent element din întregul Univers și, deși concentrația sa este neglijabilă în scoarța terestră, poate fi obținută din rezervele de gaze naturale și de minerale radioactive de uraniu și toriu..
Aici heliul demonstrează un alt fapt curios: este un gaz mult mai abundent în subsol decât în atmosferă, unde ajunge să scape de Pământ și de câmpul său gravitațional..
Indice articol
- 1 Istorie
- 2 Proprietăți fizice și chimice
- 2.1 Aspect
- 2.2 Număr atomic (Z)
- 2.3 Masa molară
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Punct triplu
- 2.8 Punct critic
- 2.9 Căldura de fuziune
- 2.10 Căldura de vaporizare
- 2.11 Capacitatea de căldură molară
- 2.12 Presiunea vaporilor
- 2.13 Energiile de ionizare
- 2.14 Solubilitate
- 2.15 Reactivitate
- 2.16 numărul de oxidare
- 3 Structură și configurație electronică
- 3.1 Dimers
- 3.2 Heliu II
- 3.3 Cristale
- 4 Unde se găsește și se obține
- 4.1 Cosmos și roci
- 4.2 Aerul și mările
- 4.3 Lichefierea și distilarea gazelor naturale
- 5 izotopi
- 6 Riscuri
- 7 utilizări
- 7.1 Sisteme de presiune și purjare
- 7.2 Detectarea scurgerilor
- 7.3 Gaz transportator
- 7.4 Baloane și blimps
- 7.5 Scufundări
- 7.6 Suduri cu arc
- 7.7 Superconductori
- 8 Referințe
Poveste
Heliul nu a fost descoperit pe Pământ, ci pe Soare. De fapt, numele său provine din cuvântul grecesc „helios” care înseamnă soare. Existența elementului prin el însuși contrasta tabelul periodic al lui Dmitri Mendeleev, întrucât nu exista loc în el pentru un gaz nou; adică până atunci nu se bănuia absolut nimic despre gazele nobile.
Numele „helium”, scris în engleză ca „helium”, s-a încheiat cu sufixul -ium referindu-se la acesta ca un metal; tocmai pentru că nu a putut fi admisă existența unui alt gaz decât oxigenul, hidrogenul, fluorul, clorul și azotul.
Acest nume a fost desemnat de astronomul englez Norman Lockyer, care a studiat din Anglia ceea ce a fost observat de astronomul francez Jules Janssen în India, în timpul unei eclipse de soare din 1868.
Era o linie spectrală galbenă a unui element necunoscut până acum. Lockyer a susținut că acest lucru se datorează prezenței unui nou element chimic găsit în Soare.
În 1895, aproape douăzeci de ani mai târziu, chimistul scoțian Sir William Ramsay a recunoscut același spectru dintr-un gaz rămas când a studiat un mineral radioactiv: cleveita. Deci, a existat heliu și aici pe Pământ.
Proprietati fizice si chimice
Aspect
Heliul este un gaz incolor, inodor, care nu are gust și este, de asemenea, inert. Cu toate acestea, atunci când este aplicat un șoc electric și, în funcție de diferența de tensiune, acesta începe să strălucească ca o ceață cenușie-violet (imaginea de mai sus), apoi să strălucească cu o strălucire portocalie. Prin urmare, luminile cu heliu sunt portocalii.
Număr atomic (Z)
Două
Masă molară
4,002 g / mol
Punct de topire
-272,2 ºC
Punct de fierbere
-268,92 ºC
Densitate
-0,1786 g / L, în condiții normale, adică în fază gazoasă.
-0.145 g / ml, la punctul de topire, heliu lichid.
-0,125 g / ml, exact în momentul în care heliul începe să fiarbă.
-0,187 g / ml, la 0 K și 25 atm, adică heliu solid la acele condiții specifice de presiune și temperatură.
Punct triplu
2.177 K și 5.043 kPa (0,04935 atm)
Punct critic
5.1953 K și 0.22746 MPa (2.2448 atm)
Căldura de fuziune
0,0138 kJ / mol
Căldura de vaporizare
0,0829 kJ / mol
Capacitatea de căldură molară
20,78 J / (mol K)
Presiunea de vapori
0,9869 atm la 4,21 K. Această valoare vă oferă o idee despre cât de heliu poate fi și cât de ușor poate scăpa la temperatura camerei (aproape de 298 K).
Energiile de ionizare
-Primul: 2372,3 kJ / mol (He+ gazos)
-Al doilea: 5250,5 kJ / mol (HeDouă+ gazos)
Energiile de ionizare pentru heliu sunt deosebit de mari, deoarece atomul gazos trebuie să piardă un electron, care are o puternică sarcină nucleară eficientă. Poate fi de asemenea înțeles luând în considerare dimensiunea mică a atomului și cât de „aproape” sunt cei doi electroni de nucleu (cu cei doi protoni și doi neutroni ai săi).
Solubilitate
În apă, se dizolvă 0,97 ml pentru fiecare 100 ml de apă la 0 ° C, ceea ce înseamnă că este slab solubil.
Reactivitate
Heliul este al doilea element chimic cel mai puțin reactiv din natură. În condiții normale, este corect să spunem că este un gaz inert; Niciodată (se pare) un compus de heliu nu poate fi manipulat într-o cameră sau laborator fără presiuni enorme care acționează asupra acestuia; sau poate temperaturi dramatic ridicate sau scăzute.
Un exemplu pe care îl vedem în compusul NaDouăEl, care este stabil numai sub o presiune de 300 GPa, s-a reprodus într-o celulă de nicovală diamantată.
În timp ce legăturile chimice din NaDouăAceștia sunt „ciudați” având electronii bine localizați în cristale, sunt departe de a fi simple interacțiuni Van der Walls și, prin urmare, nu constau pur și simplu din atomi de heliu prinși de agregate moleculare. Aici apare dilema între care compușii de heliu sunt reali și care nu..
De exemplu, moleculele de azot la presiuni ridicate pot prinde un atom de heliu pentru a forma un fel de clatrat, He (NDouă)unsprezece.
La fel, există complexele endoedrice ale cationilor fullereni, C60+n și C70+n, în ale cărei cavități pot găzdui atomi de heliu; și cationul molecular HeH+ (He-H+), întâlnită în nebuloase foarte îndepărtate.
Numărul de oxidare
Cine din curiozitate încearcă să calculeze numărul de oxidare pentru heliu din oricare dintre compușii săi va constata că acesta este egal cu 0. În NaDouăEl, de exemplu, s-ar putea crede că formula sa corespunde unor ioni Na ipoteticiDouă+eu amDouă-; dar ar fi să presupunem că are un caracter ionic pur, când în realitate legăturile sale sunt departe de a fi așa.
Mai mult, heliul nu câștigă electroni deoarece nu îi poate găzdui în orbitalul 2s, indisponibil din punct de vedere energetic; Nici nu este posibil să le piardă, din cauza dimensiunii reduse a atomului său și a marii sarcini nucleare eficiente a nucleului său. De aceea heliul participă întotdeauna (în teorie) ca un atom He0 în compușii săi derivați.
Structura și configurația electronică
Heliul, ca toate gazele observate pe o macroscală, ocupă volumul recipientelor care îl stochează, având astfel o formă nedeterminată. Cu toate acestea, când temperatura scade și începe să se răcească sub -269 ° C, gazul se condensează într-un lichid incolor; heliu I, prima dintre cele două faze lichide pentru acest element.
Motivul pentru care heliul se condensează la o temperatură atât de scăzută se datorează forțelor scăzute de împrăștiere care îi țin atomi împreună; oricare ar fi faza luată în considerare. Acest lucru poate fi explicat din configurația sa electronică:
1sDouă
În care doi electroni ocupă orbitalul atomic 1s. Atomul de heliu poate fi vizualizat ca o sferă aproape perfectă, a cărei periferie electronică omogenă este puțin predispusă la polarizare prin sarcina nucleară efectivă a celor doi protoni din nucleu..
Astfel, momentele dipolare spontane și induse sunt rare și foarte slabe; deci temperatura trebuie să se apropie de zero absolut, astfel încât atomii He să se apropie suficient de încet și să realizeze că forțele lor de dispersie definesc un lichid; sau chiar mai bine, un cristal de heliu.
Dimers
În faza gazoasă, spațiul care separă atomii de He este astfel încât se poate presupune că sunt întotdeauna separați unul de celălalt. Atât de mult încât într-o fiolă cu volum mic, heliul apare incolor până când este supus unei descărcări electrice, care își ionizează atomii într-o ceață cenușie și nu foarte strălucitoare..
Cu toate acestea, în faza lichidă atomii de He, chiar și cu interacțiunile lor slabe, nu mai pot fi „ignorați”. Acum, forța de dispersie le permite să se unească momentan pentru a forma dimeri: He-He sau HeDouă. Prin urmare, heliul I poate fi considerat ca grupuri vaste de ElDouă în echilibru cu atomii săi în faza de vapori.
De aceea heliul I este atât de dificil de diferențiat de vaporii săi. Dacă acest lichid este vărsat din recipientul său etanș, acesta scapă ca o flacără albicioasă..
Heliu II
Când temperatura scade și mai mult, atingând 2.178 K (-270.972 ° C), are loc o tranziție de fază: heliul I este transformat în heliu II.
Din acest punct, lichidul de heliu deja fascinant devine un fluid superfluid sau cuantic; adică proprietățile lor macroscopice se manifestă ca și cum dimerii HeDouă erau atomi individuali (și poate că sunt). Îi lipsește vâscozitatea completă, deoarece nu există nicio suprafață care să poată opri un atom în timpul alunecării sau „urcării” acestuia..
De aceea heliul II poate urca pe pereții unui recipient de sticlă depășind forța gravitațională; oricât de mari ar fi acestea, atâta timp cât suprafața rămâne la aceeași temperatură și, prin urmare, nu se volatilizează.
Datorită acestui fapt, heliul lichid nu poate fi depozitat în recipiente de sticlă, deoarece ar scăpa la cea mai mică fisură sau spațiu; foarte asemănător cu modul în care s-ar întâmpla cu un gaz. În schimb, oțelul inoxidabil este utilizat pentru proiectarea unor astfel de nave (rezervoare Dewars).
Cristale
Chiar dacă temperatura ar scădea la 0 K (zero absolut), forța de împrăștiere între atomii He nu ar fi suficient de puternică pentru a le ordona într-o structură cristalină. Pentru ca solidificarea să se producă, presiunea trebuie să crească la aproximativ 25 atm; și apoi apar cristale compacte hexagonale de heliu (hcp).
Studiile geofizice arată că această structură hcp rămâne neschimbată, indiferent de cât crește presiunea (până la ordinea gigapascalilor, GPa). Cu toate acestea, există o regiune îngustă în diagrama lor presiune-temperatură în care aceste cristale hcp suferă o tranziție la o fază cubică centrată pe corp (bcc)..
Unde se găsește și se obține
Cosmos și roci

Heliul este al doilea cel mai abundent element din întregul Univers, al doilea doar după hidrogen. Stelele produc în mod constant cantități incomensurabile de atomi de heliu prin fuziunea a doi nuclei de hidrogen în timpul procesului de nucleosinteză..
La fel, orice proces radioactiv care emite particule α este o sursă de producție a atomilor de heliu dacă aceștia interacționează cu electronii din mediu; de exemplu, cu cele ale unui corp stâncos în depozite de minerale radioactive de uraniu și toriu. Aceste două elemente suferă o descompunere radioactivă, începând cu uraniu:
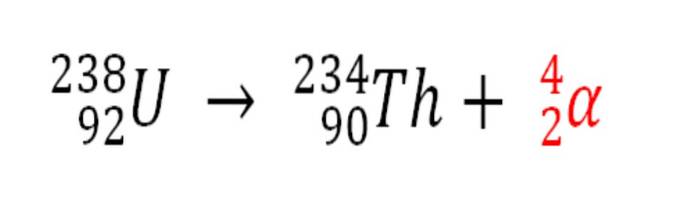
Prin urmare, în rocile în care sunt concentrate aceste minerale radioactive, atomii de heliu vor fi prinși, care vor fi eliberați odată ce sunt digerați în medii acide..
Printre unele dintre aceste minerale se numără cleveita, carnotita și uraninita, toate compuse din oxizi de uraniu (UODouă sau U3SAU8) și toriu, metale grele și impurități de pământuri rare. Heliul, irigat prin canale subterane, poate ajunge să se acumuleze în rezervoare de gaze naturale, izvoare minerale sau în fiare de călcat meteorice.
Se estimează că o masă de heliu echivalentă cu 3000 de tone este produsă anual în litosferă, din dezintegrarea radioactivă a uraniului și torului..
Aerul și mările
Heliul nu este foarte solubil în apă, așa că mai devreme decât mai târziu ajunge să urce din adâncuri (oriunde ar fi originea), până când traversează straturile atmosferei și ajunge în cele din urmă la spațiul cosmic. Atomii săi sunt atât de mici și ușori încât câmpul gravitațional al Pământului nu îi poate reține în atmosferă..
Datorită celor de mai sus, concentrația de heliu atât în aer (5,2 ppm), cât și în mări (4 ppt) este foarte scăzută..
Dacă am dori să-l extragem din oricare dintre aceste două medii, cea mai bună opțiune ar fi aerul, care ar trebui mai întâi să fie supus lichefierii pentru a-și condensa toate gazele componente, în timp ce heliul rămâne în stare gazoasă..
Cu toate acestea, nu este practic să obțineți heliu din aer, ci din roci îmbogățite cu minerale radioactive; sau mai bine, din rezervele de gaze naturale, unde heliul poate reprezenta până la 7% din masa sa totală.
Lichefierea și distilarea gazelor naturale
În loc de lichefierea aerului, este mai ușor și mai profitabil să folosești gaz natural, a cărui compoziție de heliu este, fără îndoială, mult mai mare. Astfel, materia primă prin excelență (comercială) pentru obținerea heliului este gazul natural, care poate fi supus și distilării fracționate.
Produsul final al distilării este finalizat prin purificare cu cărbune activ, prin care trece un heliu foarte pur. Și, în cele din urmă, heliul este separat de neon printr-un proces criogen în care este utilizat heliu lichid..
Izotopi
Heliul apare predominant în natură ca izotop 4El, al cărui nucleu gol este celebra particulă α. Acest atom de 4Are doi neutroni și doi protoni. În mai puțină abundență este izotopul 3El, care are un singur neutron. Primul este mai greu (are o masă atomică mai mare) decât al doilea.
Astfel, perechea de izotopi 3Am și 4El este cel care definește proprietățile măsurabile și ceea ce înțelegem despre heliu ca element chimic. Din moment ce 3El este mai ușor, se presupune că atomii săi au energie cinetică mai mare și că, prin urmare, au nevoie de o temperatură și mai scăzută pentru a coezi într-un superfluid.
3El este considerat o specie foarte rară aici pe Pământ; cu toate acestea, pe solurile lunare este mai abundent (de aproximativ 2000 de ori mai mult). De aceea, Luna a făcut obiectul unor proiecte și povești ca posibilă sursă de 3El, care ar putea fi folosit ca combustibil nuclear pentru nava spațială a viitorului.
Printre alți izotopi de heliu se pot menționa următoarele, cu timpul lor de înjumătățire respectiv: 5Eu am (t1/2= 7,610−22 s), 6Eu am (t1/2= 0,8 s) și 8Eu am (t1/2= 0.119 s).
Riscuri
Heliul este un gaz inert și, prin urmare, nu participă la niciuna dintre reacțiile care apar în corpul nostru..
Atomii săi intră și ies practic expirați fără ca interacțiunile lor cu biomoleculele să producă un efect ulterior; cu excepția sunetului emis de corzile vocale, care devin mai înalte și au o frecvență mai mare.
Persoanele care inhalează heliu dintr-un balon (cu măsură) vorbesc cu o voce acută, similară cu cea a unei veverițe (sau rațe).
Problema este că, dacă inhalează o cantitate inadecvată de heliu, riscă să se sufoce, deoarece atomii săi înlocuiesc moleculele de oxigen; și, prin urmare, nu veți putea respira până nu expirați tot heliul, care, la rândul său, datorită presiunii sale poate rupe țesutul pulmonar sau poate provoca barotraumatism.
Au fost raportate cazuri de persoane care au murit din cauza inhalării heliului din cauza celor ce tocmai au fost explicate.
Pe de altă parte, deși nu reprezintă un risc de incendiu, dată fiind lipsa de reactivitate față de oxigen (sau altă substanță), dacă este depozitat sub presiune ridicată și scapă, scurgerea acestuia poate fi periculoasă din punct de vedere fizic..
Aplicații
Proprietățile fizice și chimice ale heliului îl fac nu numai un gaz special, ci și o substanță foarte utilă pentru aplicații care necesită temperaturi extrem de scăzute. În această secțiune vor fi abordate unele dintre aceste aplicații sau utilizări..
Sisteme de presiune și sângerare
În unele sisteme este necesară creșterea presiunii (presurizare), iar pentru aceasta trebuie injectat sau alimentat un gaz care nu interacționează cu nici unul dintre componentele sale; de exemplu cu reactivi sau suprafețe sensibile la reacții nedorite.
Astfel, presiunea poate fi crescută cu volume de heliu, a căror inertitate chimică o face ideală în acest scop. Atmosfera inertă pe care o facilitează o depășește în anumite cazuri pe cea a azotului.
Pentru procesul invers, adică purjarea, heliul este de asemenea utilizat datorită capacității sale de a transporta tot oxigenul, vaporii de apă sau orice alt gaz, a cărui prezență doriți să o eliminați. În acest fel, presiunea sistemului este redusă odată ce heliul a fost golit..
Detectarea scurgerilor
Heliul se poate scurge prin cea mai mică fisură, deci servește și pentru detectarea scurgerilor din țevi, recipiente cu vid ridicat sau rezervoare criogenice.
Uneori detectarea se poate face vizual sau prin atingere; cu toate acestea, în cea mai mare parte un detector este ceea ce „dă” semnalul unde și cât de mult heliu scapă din sistemul sub inspecție..
Gaz purtător
Atomii de heliu, așa cum s-a menționat pentru sistemele de purjare, pot transporta cu ei, în funcție de presiunea lor, molecule mai grele. De exemplu, acest principiu este utilizat zilnic în analiza cromatografiei gazoase, deoarece poate trage proba atomizată de-a lungul coloanei, unde interacționează cu faza staționară..
Baloane și dirijabile

Datorită densității sale scăzute în comparație cu aerul și, din nou, a lipsei de reactivitate cu oxigenul, a fost folosit pentru a umfla baloane la petrecerile copiilor (amestecate cu oxigen, astfel încât nimeni să nu se sufoce din respirația sa) și aeronavele (imaginea de sus), fără a reprezenta un risc de incendiu.
Scufundări

Când scafandrii coboară la adâncimi mai mari, le este greu să respire datorită presiunii mari exercitate de apă. De aceea, heliul este adăugat în rezervoarele lor de oxigen pentru a scădea densitatea gazului pe care scafandrii îl respiră și expiră și, astfel, acesta poate fi expirat cu mai puțină muncă..
Suduri cu arc
În procesul de sudare, arcul electric asigură suficientă căldură pentru ca cele două metale să se unească. Dacă se face sub atmosferă de heliu, metalul incandescent nu va reacționa cu oxigenul din aer pentru a deveni oxidul respectiv; de aceea heliul previne acest lucru.
Supraconductori
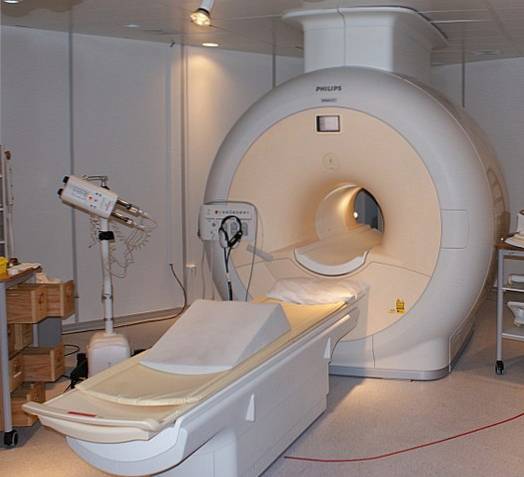
Heliul lichid este atât de rece încât poate îngheța metalele în supraconductori. Datorită acestui fapt, a fost posibil să se producă magneți foarte puternici, care, răciti cu heliu lichid, au fost folosiți în scanere de imagini sau spectrometre de rezonanță magnetică nucleară..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Andy Extance. (17 aprilie 2019). Ion hidrură de heliu detectat în spațiu pentru prima dată: dovezi găsite pentru chimia evazivă din primele minute ale universului. Recuperat de pe: chemistryworld.com
- Peter Wothers. (19 august 2009). Heliu. Chimia în elementul ei. Recuperat de pe: chemistryworld.com
- Wikipedia. (2019). Heliu. Recuperat de pe: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M. și Bassett, W. A. (1988). Structura cristalină și densitatea heliului până la 232 Kbar. Recuperat de la: articles.adsabs.harvard.edu
- Centrul Național pentru Informații despre Biotehnologie. (2019). Heliu. Baza de date PubChem. CID = 23987. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (6 februarie 2017). Sus, sus și departe: chimiștii spun „da”, heliul poate forma compuși. Universitatea de Stat din Utah. Recuperat de pe: phys.org
- Steve Gagnon. (s.f.). Izotopii elementului heliu. Jefferson Lab. Recuperat de pe: education.jlab.org
- Advameg, Inc. (2019). Heliu. Recuperat de pe: chemistryexplained.com



Nimeni nu a comentat acest articol încă.