
Acetanilidă (C8H9NO) Structură, proprietăți, sinteză
acetanilidă (C8H9NO) este o amidă aromatică care primește mai multe denumiri suplimentare: N-acetilarilamină, N-fenilacetamidă și acetanil. Este prezentat ca un solid inodor sub formă de fulgi, natura sa chimică este amidă și, ca atare, poate forma gaze inflamabile atunci când reacționează cu agenți reductori puternici..
În plus, este o bază slabă, putând reacționa cu agenți de deshidratare precum PDouăSAU5 pentru a da naștere unui nitril. S-a constatat că acetanilida are acțiune analgezică și antipiretică și a fost utilizată în 1886 sub numele de Antifebrina de A. Cahn și P. Hepp..

În 1899, acidul acetilsalicilic (aspirina) a fost introdus pe piață, care avea aceleași acțiuni terapeutice ca acetanilida. Deoarece utilizarea acetanilidei a fost legată de apariția cianozei la pacienți - o consecință a methemoglobinemiei induse de acetanilidă - utilizarea acesteia a fost exclusă..
Ulterior, s-a stabilit că acțiunea analgezică și antipiretică a acetanilidei rezida într-un metabolit al acesteia numit paracetamol (acetoaminofen), care nu a avut efectele sale toxice, așa cum au sugerat Axelrod și Brodie..
Indice articol
- 1 Structura chimică
- 1.1 Structuri de rezonanță și interacțiuni intermoleculare
- 2 Proprietăți chimice
- 2.1 Greutatea moleculară
- 2.2 Descrierea chimică
- 2.3 Miros
- 2.4 Aromă
- 2.5 Punctul de fierbere
- 2.6 Punct de topire
- 2.7 Punct de aprindere sau punct de aprindere
- 2.8 Densitate
- 2.9 Densitatea vaporilor
- 2.10 Presiunea vaporilor
- 2.11 Stabilitate
- 2.12 Volatilitate
- 2.13 Autoinflamarea
- 2.14 Descompunerea
- 2,15 pH
- 2.16 Solubilitate
- 3 Sinteza
- 4 Aplicații
- 5 Referințe
Structura chimică
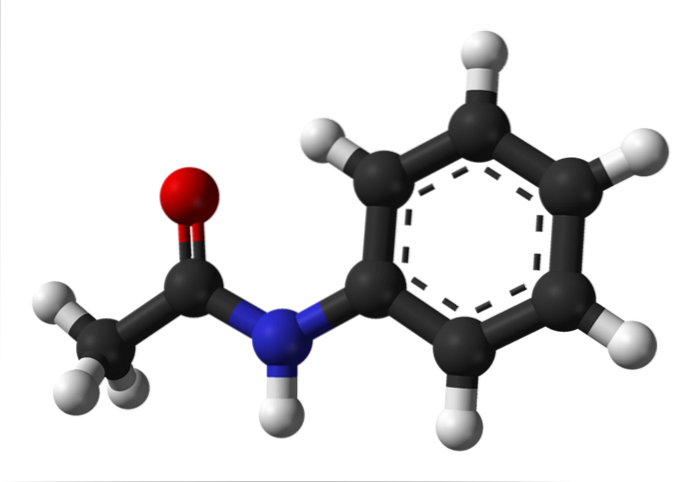
Imaginea superioară reprezintă structura chimică a acetanilidei. În dreapta este inelul aromatic hexagonal de benzen (cu linii punctate), iar în stânga este motivul pentru care compusul este format dintr-o amidă aromatică: grupul acetamido (HNCOCH3).
Grupul acetamido conferă inelului benzenic un caracter polar mai mare; adică creează un moment dipol în molecula de acetanilidă.
De ce? Deoarece azotul este mai electronegativ decât oricare dintre atomii de carbon din inel și este, de asemenea, legat de gruparea acil, al cărui atom de O atrage, de asemenea, densitatea electronilor.
Pe de altă parte, aproape întreaga structură moleculară a acetanilidei se sprijină pe același plan datorită hibridizării spDouă a atomilor care o compun.
Există o excepție legată de cele din grupul -CH3, ai cărui atomi de hidrogen alcătuiesc vârfurile unui tetraedru (sferele albe din extrema stângă ies din plan).
Structuri de rezonanță și interacțiuni intermoleculare
Perechea solitară fără partajare în atomul de N circulă prin sistemul π al inelului aromatic, originând mai multe structuri de rezonanță. Cu toate acestea, una dintre aceste structuri se termină cu o sarcină negativă pe atomul de O (mai electronegativă) și o sarcină pozitivă pe atomul de N..
Astfel, există structuri de rezonanță în care o sarcină negativă se mișcă în inel și o alta în care se află în atomul O. Ca o consecință a acestei "asimetrii electronice" - care vine mână în mână cu asimetria moleculară -, acetanilida interacționează intermolecular prin dipol. -forțele dipole.
Cu toate acestea, interacțiunile de legare a hidrogenului (N-H-O-…) între două molecule de acetanilidă sunt, de fapt, forța predominantă în structura lor cristalină..
Astfel, cristalele de acetanilidă constau din celule unitare ortorombice de opt molecule orientate în forme de „panglică plană” prin legăturile lor de hidrogen..
Acest lucru poate fi vizualizat prin plasarea unei molecule de acetanilidă deasupra celeilalte, în paralel. Deci, ca și grupurile HNCOCH3 se suprapun spațial, formează legături de hidrogen.
În plus, între aceste două molecule, o a treia poate „aluneca”, dar cu inelul său aromatic îndreptat spre partea opusă..
Proprietăți chimice
Greutate moleculară
135,166 g / mol.
Descrierea chimică
Alb solid sau aproape alb. Formează fulgi albi strălucitori sau o pulbere cristalină albă.
Miros
Toaletă.
Gust
Ușor picant.
Punct de fierbere
304 ° C până la 760 mmHg (579 ° F până la 760 mmHg).
Punct de topire
114,3 ° C (237,7 ° F).
Punct de aprindere sau punct de aprindere
169 ° C (337 ° F). Măsurare realizată în sticlă deschisă.
Densitate
1.219 mg / mL la 15 ° C (1.219 mg / mL la 59 ° F)
Densitatea vaporilor
4,65 față de aer.
Presiunea de vapori
1 mmHg la 237ºF, 1,22 × 10-3 mmHg la 25ºC, 2Pa la 20ºC.
Stabilitate
Este supus unei rearanjări chimice atunci când este expus la lumina UV. Cum se schimbă structura? Grupul acetil formează noi legături pe inel la pozițiile orto și para. În plus, este stabil în aer și incompatibil cu agenți oxidanți puternici, caustici și alcali..
Volatilitate
Apreciat volatil la 95 ° C.
Auto-aprindere
1004ºF.
Descompunere
Se descompune atunci când este încălzit, emanând un fum foarte toxic.
pH
5-7 (10 g / L de HDouăSau la 25 ° C)
Solubilitate
- În apă: 6,93 × 103 mg / mL la 25 ° C.
- Solubilitatea a 1 g acetanilidă în diferite lichide: în 3,4 ml alcool, 20 ml apă clocotită, 3 ml metanol, 4 ml acetonă, 0,6 ml alcool fierbinte, 3,7 ml cloroform, 5 ml gliecerol, 8 ml de dioxan, 47 ml benzen și 18 ml eter. Hidratul de clor crește solubilitatea acetanilidei în apă.
Sinteză
Se sintetizează prin reacția anhidridului acetic cu acetanilida. Această reacție apare în multe texte de chimie organică (Vogel, 1959):
C6H5NHDouă + (CH3CO)DouăO => C6H5NHCOCH3 + CH3COOH
Aplicații
-Este un agent inhibitor al procesului de descompunere a peroxidului de hidrogen (peroxid de hidrogen).
-Stabilizează lacurile cu esteri de celuloză.
-Acesta intervine ca intermediar în accelerarea producției de cauciuc. La fel, este un intermediar în sinteza unor coloranți și camfor..
-Acționează ca un precursor în sinteza penicilinei.
-Se utilizează la producerea clorurii de 4-acetamidosulfonilbenzen. Acetanilida reacționează cu acidul clorosulfonic (HSO3Cl), producând astfel clorură de 4-aminosulfonilbenzen. Aceasta reacționează cu amoniac sau o amină organică primară pentru a forma sulfonamide..
-A fost folosit experimental în secolul al XIX-lea în dezvoltarea fotografiei.
-Acetanilida este utilizată ca marker al fluxurilor electroosmotice (EOF) în electroforeza capilară pentru studiul legăturii dintre medicamente și proteine..
-Recent (2016) acetanilida a fost legată de 1- (ω-fenoxialchiluracil) în experimente de inhibare a replicării virusului hepatitei C. Acetanilida se leagă de poziția 3 a inelului pirimidinic.
-Rezultatele experimentale indică o reducere a replicării genomului viral, indiferent de genotipul viral..
-Înainte de identificarea toxicității acetanilidei, aceasta a fost utilizată ca analgezic și antipiretic din 1886. Mai târziu (1891), a fost utilizată în tratamentul bronșitei cronice și acute de către Grün.
Referințe
- J. Brown și D. E. C. Corbridge. (1948). Structura cristalină a acetanilidei: utilizarea radiațiilor infraroșii polarizate. Volumul naturii 162, pagina 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) Utilizarea acetanilidei în tratamentul bronșitei acute și cronice. Lancet 137 (3539): 1424-1426.
- Magri, A. și colab. (2016). Explorarea derivaților acetanilidici ai 1- (ω-fenoxialchil) uracililor ca noi inhibitori ai replicării virusului hepatitei C. Sci. Rep. 6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilidă. Adus pe 5 iunie 2018, de pe: sigmaaldrich.com
- Raport de evaluare inițială SIDS pentru al 13-lea SIAM. Acetanilidă. [PDF]. Adus pe 5 iunie 2018, de pe: inchem.org
- Wikipedia. (2018). Acetanilidă. Adus pe 05 iunie 2018, de pe: en.wikipedia.org
- PubChem. (2018). Acetanilidă. Adus la 5 iunie 2018 de la: pubchem.ncbi.nlm.nih.gov

Nimeni nu a comentat acest articol încă.