
Hibridizare chimică sp, sp2, sp3
hibridizare chimică este „amestecul” de orbitali atomici, al cărui concept a fost introdus de chimistul Linus Pauling în 1931 pentru a acoperi imperfecțiunile Teorii Bondurilor din Valencia (TEV). Ce imperfecțiuni? Acestea sunt: geometrii moleculare și lungimi de legături echivalente în molecule precum metanul (CH4).
Potrivit TEV, în metan orbitalele atomice C formează patru legături σ cu patru atomi de H. Orbitalele 2p, cu forme de forme (imaginea de jos) a lui C sunt perpendiculare una pe cealaltă, deci H ar trebui să fie la câțiva de la alții la Unghi de 90º.
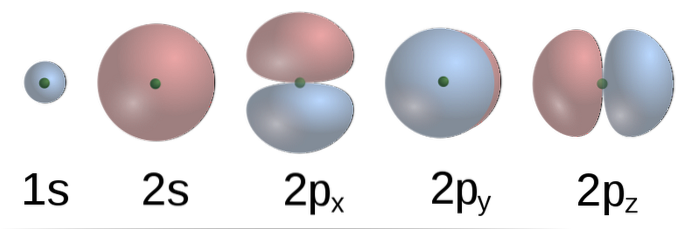
În plus, orbitalul 2s (sferic) al lui C se leagă de orbitalul 1s al lui H la un unghi de 135º față de celelalte trei H. Cu toate acestea, experimental s-a constatat că unghiurile din CH4 sunt 109,5º și că, în plus, lungimile legăturilor C-H sunt echivalente.
Pentru a explica acest lucru, o combinație a orbitalilor atomici originali trebuie considerată a forma patru orbitali hibrizi degenerați (de energie egală). Aici intră în joc hibridizarea chimică. Cum sunt orbitalii hibrizi? Depinde de orbitalii atomici care îi generează. Ele prezintă, de asemenea, un amestec de caracteristici electronice ale acestora.
Indice articol
- 1 hibridizare sp3
- 1.1 Interpretare
- 1.2 Abateri ale unghiurilor de legătură
- 2 hibridizare sp2
- Hibridizare 3 sp
- 4 Referințe
Hibridizare sp3
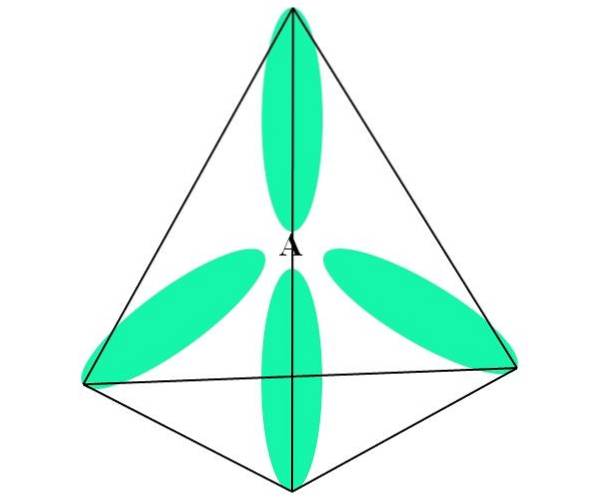
În cazul CH4, hibridizarea lui C este sp3. Din această abordare, geometria moleculară este explicată cu patru orbitali sp3 La o distanță de 109,5º și îndreptată spre vârfurile unui tetraedru.
În imaginea de sus puteți vedea cum orbitalele sp3 (colorat în verde) stabilesc un mediu electronic tetraedric în jurul atomului (A, care este C pentru CH4).
De ce 109,5º și nu alte unghiuri, pentru a „desena” o geometrie diferită? Motivul este că acest unghi minimizează repulsiile electronice ale celor patru atomi care se leagă de A.
Astfel, molecula CH4 poate fi reprezentat ca un tetraedru (geometrie moleculară tetraedrică).
Dacă, în loc de H, C ar forma legături cu alte grupuri de atomi, care ar fi atunci hibridizarea lor? Atâta timp cât carbonul formează patru legături σ (C-A), hibridizarea lor va fi sp3.
În consecință, se poate presupune că în alți compuși organici, cum ar fi CH3OH, CCl4, C (CH3)4, C6H12 (ciclohexan) etc., carbonul are hibridizare sp3.
Acest lucru este esențial pentru schițarea structurilor organice, în care carbonii cu legătură simplă reprezintă puncte de divergență; adică structura nu rămâne într-un singur plan.
Interpretare
Care este cea mai simplă interpretare pentru acești orbitali hibrizi fără a aborda aspectele matematice (funcțiile de undă)? Orbitalii sp3 implică faptul că au fost originate de patru orbitali: unul s și trei p.
Deoarece combinația acestor orbitali atomici este presupusă a fi ideală, cei patru orbitali sp3 rezultate sunt identice și ocupă orientări diferite în spațiu (cum ar fi în orbitalele pX, pDa Și pz).
Cele de mai sus se aplică pentru restul hibridizărilor posibile: numărul orbitalilor hibrizi care se formează este același cu cel al orbitalilor atomici care sunt combinați. De exemplu, sp orbitali hibrizi3dDouă sunt formate din șase orbitali atomici: unul s, trei p și doi d.
Abateri ale unghiului de legătură
Potrivit teoriei Valencia Shell Electronic Pair Repulsion (RPECV), o pereche de electroni liberi ocupă mai mult volum decât un atom legat. Acest lucru face ca legăturile să se îndepărteze, reducând tensiunea electronică și devierea unghiurilor de la 109,5º:
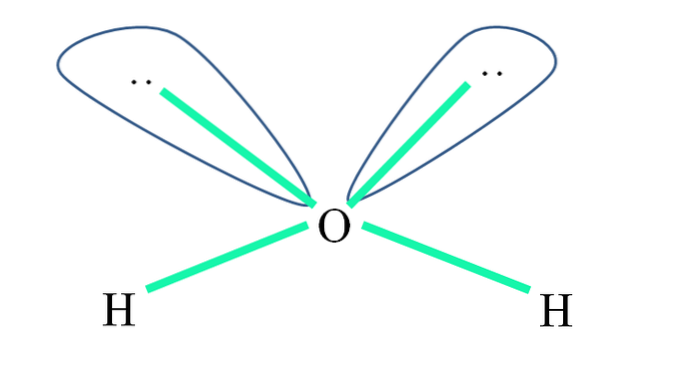
De exemplu, în molecula de apă atomii de H sunt legați de orbitalii sp3 (în verde), și, de asemenea, perechile nepartajate de electroni ":" ocupă acești orbitali.
Repulsiile acestor perechi de electroni sunt de obicei reprezentate ca „două globuri cu ochi”, care, datorită volumului lor, resping cele două legături σ O-H.
Astfel, în apă unghiurile de legătură sunt de fapt 105º, în loc de 109,5º preconizate pentru geometria tetraedrică..
Ce geometrie face atunci HDouăSAU? Are o geometrie unghiulară. De ce? Pentru că, deși geometria electronică este tetraedrică, două perechi de electroni nepartajați o distorsionează la o geometrie moleculară unghiulară.
Hibridizare spDouă
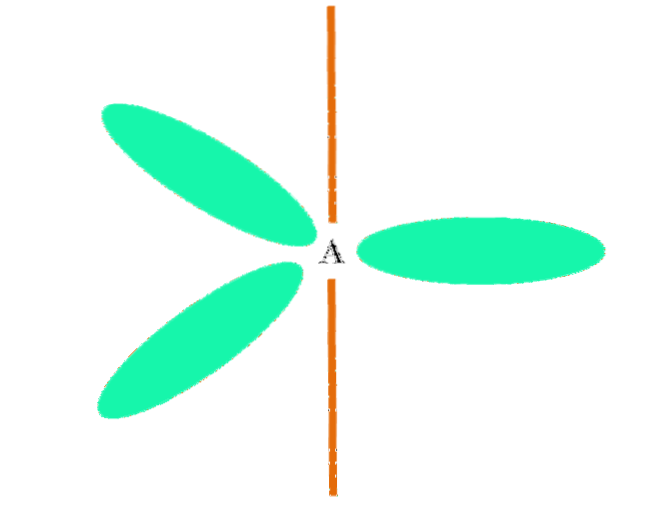
Când un atom combină doi orbitali p și unu s, generează trei orbitali hibrizi spDouă; totuși, un orbital p rămâne neschimbat (deoarece există trei dintre ele), care este reprezentat ca o bară portocalie în imaginea superioară.
Aici, cei trei orbitali spDouă sunt colorate în verde pentru a evidenția diferența lor față de bara portocalie: orbitalul "pur" p.
Un atom cu hibridizare spDouă poate fi vizualizat ca un etaj plat trigonal (triunghiul desenat cu orbitalii spDouă verde), cu vârfurile sale separate de unghiuri de 120º și perpendiculare pe o bară.
Și ce rol joacă orbitalul pur p? Acela al formării unei duble legături (=). Orbitalii spDouă permite formarea a trei legături σ, în timp ce legătura orbitală pură π (o legătură dublă sau triplă implică una sau două legături π).
De exemplu, pentru a desena gruparea carbonil și structura moleculei de formaldehidă (HDouăC = O), continuă după cum urmează:
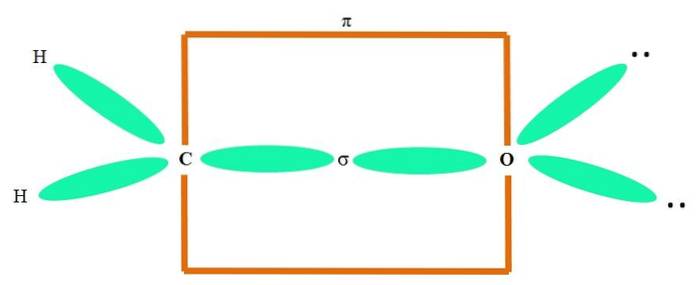
Orbitalii spDouă atât C cât și O formează o legătură σ, în timp ce orbitalii lor puri formează o legătură π (dreptunghiul portocaliu).
Se poate observa cum restul grupurilor electronice (atomii de H și perechile de electroni nepartajate) sunt situate în ceilalți orbitali sp.Două, separate de 120º.
Hibridizare sp
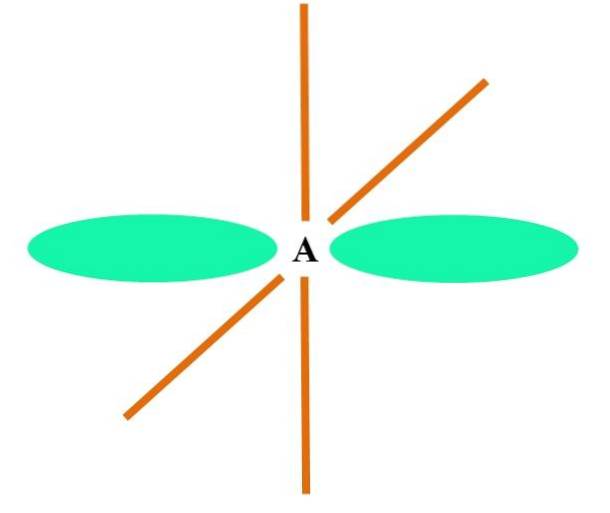
În imaginea superioară este ilustrat un atom A cu hibridizare sp. Aici, un orbital s și un orbital p se combină pentru a da naștere la doi orbitali sp degenerați. Cu toate acestea, acum doi orbitali p pur rămân nemodificați, ceea ce permite lui A să formeze două legături duble sau o legătură triplă (≡).
Cu alte cuvinte: dacă un C este conform cu cele de mai sus într-o structură (= C = sau C≡C), atunci hibridizarea sa este sp. Pentru alți atomi mai puțin ilustrativi - cum ar fi metalele de tranziție - descrierea geometriilor electronice și moleculare este complicată, deoarece orbitalii d și chiar orbitalii f sunt, de asemenea, luați în considerare..
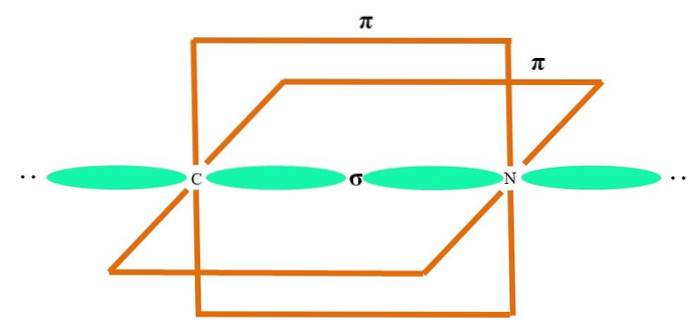
Orbitalii hibrizi sunt distanți la 180 °. Din acest motiv atomii legați sunt aranjați într-o geometrie moleculară liniară (B-A-B). În cele din urmă, imaginea inferioară arată structura anionului cianură:
Referințe
- Sven. (03 iunie 2006). S-p-orbitali. [Figura]. Adus pe 24 mai 2018, de pe: commons.wikimedia.org
- Richard C. Banks. (Mai 2002). Lipire și hibridizare. Adus pe 24 mai 2018, de pe: chemistry.boisestate.edu
- James. (2018). O comandă rapidă de hibridizare. Adus pe 24 mai 2018, de pe: masterorganicchemistry.com
- Dr. Ian Hunt. Departamentul de chimie, Universitatea din Calgary. hibridizare sp3. Adus pe 24 mai 2018, de pe: chem.ucalgary.ca
- Legătura chimică II: Geometrie moleculară și hibridizare a orbitalilor atomici Capitolul 10. [PDF]. Adus pe 24 mai 2018, de pe: wou.edu
- Quimitube. (2015). Legătura covalentă: o introducere în hibridizarea orbitală atomică. Adus pe 24 mai 2018, de pe: quimitube.com
- Shiver & Atkins. (2008). Chimie anorganică. (Ediția a patra., P. 51). Mc Graw Hill.



Nimeni nu a comentat acest articol încă.