
Proprietăți, nomenclatură, reacții, tipuri de hidrocarburi alifatice
Hidrocarburi alifatice sunt toți cei care nu au aromă, nu în sens olfactiv, ci în ceea ce privește stabilitatea chimică. Clasificarea hidrocarburilor în acest mod este în prezent prea ambiguă și imprecisă, deoarece nu face discriminare între diferite tipuri de hidrocarburi care nu sunt aromate..
Astfel, avem hidrocarburi alifatice și hidrocarburi aromatice. Acestea din urmă sunt recunoscute după unitatea lor de bază: inelul benzenic. Celelalte, pe de altă parte, pot adopta orice structură moleculară: liniară, ramificată, ciclică, nesaturată, policiclică; atâta timp cât nu au sisteme conjugate precum benzenul.

Termenul „alifatic” s-a născut din cuvântul grecesc „aleiphar”, care înseamnă grăsime, folosit și pentru a se referi la uleiuri. Prin urmare, în secolul al XIX-lea această clasificare a fost atribuită hidrocarburilor obținute din extracte uleioase; în timp ce hidrocarburile aromatice erau extrase din rășini de copaci și parfumate.
Cu toate acestea, pe măsură ce fundamentele chimiei organice au fost consolidate, s-a descoperit că există o proprietate chimică care diferenția hidrocarburile, chiar mai importante decât sursele lor naturale: aromaticitatea (și nu parfumul).
În acest fel, hidrocarburile alifatice au încetat să fie doar cele obținute din grăsimi, pentru a fi toate cele lipsite de aromaticitate. În cadrul acestei familii avem alcani, alchene și alchine, indiferent dacă sunt lineare sau ciclice. De aceea, „alifatic” este considerat imprecis; deși este util să abordăm unele aspecte generale.
De exemplu, când spuneți „capete” sau „lanțuri” alifatice, vă referiți la regiunile moleculare în care inelele aromatice sunt absente. Dintre toate hidrocarburile alifatice, cel mai simplu prin definiție este metanul, CH4; în timp ce benzenul este cel mai simplu dintre hidrocarburile aromatice.
Indice articol
- 1 Proprietățile hidrocarburilor alifatice
- 2 Nomenclatură
- 3 Reacții
- 3.1 Combustie
- 3.2 Adăugare
- 3.3 Halogenare
- 3.4 Crăpături
- 4 tipuri
- 5 utilizări
- 6 Exemple
- 7 Referințe
Proprietățile hidrocarburilor alifatice
Proprietățile hidrocarburilor alifatice variază în grade diferite, în funcție de care sunt considerate. Există cele cu mase moleculare mici și mari, precum și liniare, ramificate, ciclice sau policiclice, chiar și cele cu structuri tridimensionale uimitoare; ca și în cazul cubanezului, în formă de cub.
Cu toate acestea, există unele generalități care pot fi menționate. Majoritatea hidrocarburilor alifatice sunt gaze sau lichide hidrofobe și apolare, cu unele mai apolare decât altele, deoarece sunt incluse chiar și cele în ale căror lanțuri de carbon conțin atomi de halogen, oxigen, azot sau sulf..
De asemenea, sunt compuși inflamabili, deoarece sunt susceptibili la oxidarea în aer cu o sursă minimă de căldură. Această caracteristică devine mai periculoasă dacă adăugăm volatilitatea sa ridicată, datorită interacțiunilor dispersive slabe care mențin împreună moleculele alifatice..
Vedem acest lucru, de exemplu, în butan, un gaz care poate lichefia relativ ușor ca propanul. Ambele sunt extrem de volatile și inflamabile, făcându-le componente active în brichetele de gătit sau brichetele de buzunar..
Desigur, această volatilitate tinde să scadă pe măsură ce masa moleculară crește și hidrocarbura produce lichide din ce în ce mai vâscoase și uleioase..
Nomenclatură
Nomenclatura hidrocarburilor diferă chiar mai mult decât proprietățile lor. Dacă sunt alcani, alchene sau alchine, se respectă aceleași reguli stipulate de IUPAC: selectați cel mai lung lanț, atribuind cele mai mici numere de indicatori capătului cel mai substituit sau celor mai reactivi heteroatomi sau grupuri.
În acest fel se știe pe ce carbon se găsește fiecare substituent sau chiar nesaturările (legături duble sau triple). În cazul hidrocarburilor ciclice, denumirea este precedată de substituenții enumerați în ordine alfabetică, urmat de cuvântul „ciclu”, numărând numărul de atomi de carbon care îl compun..
De exemplu, luați în considerare următorii doi ciclohexani:
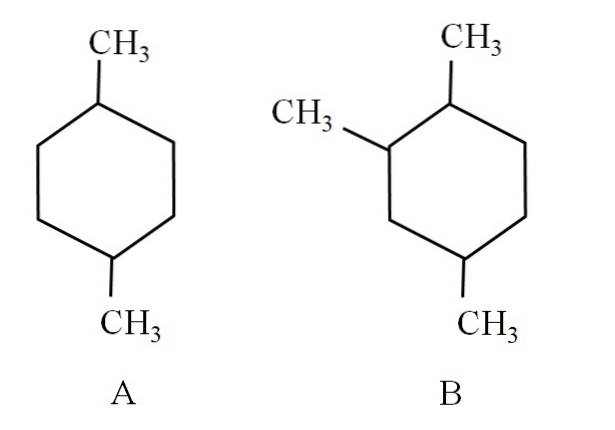
Ciclohexanul A se numește 1,4-dimetilciclohexan. Dacă inelul ar avea cinci atomi de carbon, ar fi 1,4-dimetilciclopentan. Între timp, ciclohexanul B se numește 1,2,4-trimetilciclohexan, și nu 1,4,6-ciclohexan, deoarece încearcă să utilizeze cei mai mici indicatori.
Acum, nomenclatura se poate complica foarte mult pentru hidrocarburile cu structuri bizare. Pentru ei există reguli mai specifice, care trebuie explicate separat și cu atenție; ca și în cazul dienelor, terpenelor, polienelor și compușilor policiclici.
Reacții
Combustie
Din fericire, reacțiile sunt mai puțin variate pentru aceste hidrocarburi. Unul dintre ele a fost deja menționat: ard ușor, producând dioxid de carbon și apă, precum și alți oxizi sau gaze în funcție de prezența heteroatomilor (Cl, N, P, O etc.). Cu toate acestea, CODouă si HDouăSau sunt principalele produse ale combustiei.
Plus
Dacă prezintă nesaturații, pot suferi reacții de adăugare; adică încorporează molecule mici în coloana vertebrală ca substituenți, urmând un mecanism specific. Printre aceste molecule avem apă, hidrogen și halogeni (FDouă, ClDouă, FrDouă și euDouă).
Halogenare
Pe de altă parte, hidrocarburile alifatice sub incidența radiațiilor ultraviolete (hv) și căldura pot rupe legăturile C-H pentru a le schimba cu legăturile C-X (C-F, C-Cl etc.). Aceasta este reacția de halogenare, care se observă în alcani cu lanț foarte scurt, cum ar fi metanul sau pentanul..
Cracare
O altă reacție pe care o pot suferi hidrocarburile alifatice, în special alcanii cu lanț lung, este fisurarea termică. Acesta constă în furnizarea de căldură intensă, astfel încât energia termică să rupă legăturile C-C și astfel se formează molecule mici, mai apreciate pe piața combustibililor, din molecule mari.
Cele patru reacții de mai sus sunt cele principale pe care le poate suferi o hidrocarbură alifatică, arderea fiind cea mai importantă dintre toate, deoarece nu discriminează niciun compus; toate vor arde în prezența oxigenului, dar nu toate vor adăuga molecule sau se vor descompune în molecule mici.
Tipuri
Hidrocarburile alifatice grupează un număr nesfârșit de compuși, care la rândul lor sunt clasificați într-un mod mai specific, indicând gradul de nesaturații al acestora, precum și tipul de structură pe care îl au..
În funcție de cât de nesaturați sunt, avem alcani (saturați), alcheni și alchini (nesaturați).
Alcanii se caracterizează prin faptul că au legături C-C unice, în timp ce în alchene și alchine observăm legături C = C și, respectiv, C≡C. Un mod foarte general de a le vizualiza este să gândim scheletele de carbon ale alcanilor ca lanțuri în zig-zag și îndoite, fiind „pătrate” pentru alchene și „linii drepte” pentru alchine..
Acest lucru se datorează faptului că legăturile duble și triple prezintă restricții de energie și sterice în rotațiile lor, „întărind” structurile lor..
Alcanii, alchenele și alchinele pot fi ramificate, ciclice sau policiclice. De aceea, cicloalcani, cicloalceni, cicloalchini și compuși precum decalin (structură biciclo), adamantan (similar cu o șapcă de baseball), heptalen, gonan, printre altele, sunt, de asemenea, considerați hidrocarburi alifatice..
Alte tipuri de hidrocarburi apar din alchene, cum ar fi dienele (cu două legături duble), polienele (cu multe legături duble alternative) și terpenele (compuși derivați din izopren, o dienă).
Aplicații
Din nou, utilizările acestor hidrocarburi pot varia în funcție de care este luată în considerare. Cu toate acestea, în secțiunile de proprietăți și reacții a fost clar că toate ard, nu numai pentru a elibera molecule gazoase, ci și lumină și căldură. Astfel, acestea sunt rezervoare de energie, utile pentru a servi drept combustibili sau surse de căldură..
De aceea sunt folosite ca parte a compoziției benzinei, pentru gaze naturale, în arzătoarele Bunsen și, în general, pentru a putea declanșa incendii..
Unul dintre cele mai notabile exemple este cel al acetilenei, HC≡CH, a cărei combustie permite excitarea ionilor metalici ai unei probe în spectrometria de absorbție atomică efectuată în teste analitice. De asemenea, focul rezultat poate fi folosit pentru sudare.
Hidrocarburile alifatice lichide, cum ar fi parafinele, sunt frecvent utilizate ca solvenți de extracție pentru grăsimi. În plus, acțiunea sa de solvent poate fi utilizată pentru a îndepărta petele, emailurile, vopselele sau pur și simplu pentru a prepara soluții ale unui anumit compus organic.
Cei cu cea mai mare masă moleculară, vâscoasă sau solidă, sunt folosiți pentru producerea de rășini, polimeri sau medicamente.
În ceea ce privește termenul „alifatic”, este adesea folosit pentru a se referi la acele regiuni, într-o macromoleculă, care nu au aromă. De exemplu, asfalenele sunt descrise superficial ca un nucleu aromatic cu lanțuri alifatice.
Exemple
La început s-a spus că metanul este cel mai simplu dintre hidrocarburile alifatice. Este urmat de propan, CH3CHDouăCH3, butan, CH3CHDouăCHDouăCH3, pentan, CH3CHDouăCHDouăCHDouăCH3, octan, nonan, decan și așa mai departe, având alcani din ce în ce mai lungi.
Același lucru este valabil și pentru etilenă, CHDouă= CHDouă, propenă, CH3CH = CHDouă, butenă, CH3CHDouăCH = CH3, iar pentru restul alchinelor. Dacă există două legături duble, acestea sunt diene, iar dacă există mai mult de două, poliene. La fel, pot exista legături duble și triple în același schelet, crescând complexitatea structurală..
Printre cicloalcani putem menționa ciclopropanul, ciclobutanul, ciclopentanul, ciclohexanul, cicloheptanul, ciclooctanul, precum și ciclohexanul și ciclohexina. Derivații ramificați sunt obținuți la rândul lor din toate aceste hidrocarburi, exemplele disponibile multiplicându-se și mai mult (cum ar fi 1,4-dimetilciclohexan).
Dintre cele mai reprezentative terpene avem limonen, mentol, pinen, vitamina A, squalen etc. Polietilena este un polimer saturat cu unități -CHDouă-CHDouă-, deci este și un exemplu al acestor hidrocarburi. Alte secțiuni au fost deja citate în secțiunile anterioare.
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Helmenstine, Anne Marie, dr. (22 august 2019). Definirea hidrocarburii alifatice. Recuperat de pe: thoughtco.com
- Wikipedia. (2019). Compus alifatic. Recuperat de pe: en.wikipedia.org
- Chimie LibreTexte. (20 august 2019). Hidrocarburi alifatice. Recuperat de pe: chem.libretexts.org
- Elizabeth Wyman. (2019). Hidrocarburi alifatice: definiție și proprietăți. Studiu. Recuperat de la: study.com



Nimeni nu a comentat acest articol încă.