
Structură, proprietăți și utilizări ale hidrurii de beriliu (BeH2)
hidrură de beriliu Este un compus covalent format între beriliu metal alcalin pământos și hidrogen. Formula sa chimică este BeHDouă, și fiind covalentă, nu constă din ioni BeDouă+ nici H-. Este, împreună cu LiH, una dintre cele mai ușoare hidruri metalice capabile să fie sintetizate.
Este produs prin tratarea dimetilberiliei, Be (CH3)Două, cu hidrură de litiu aluminiu, LiAlH4. Cu toate acestea, BeHDouă mai pur se obține din piroliza di-terț-butilberil, Be (C (CH3)3)Două la 210 ° C.

Ca moleculă individuală în stare gazoasă, este liniară în geometrie, dar în stare solidă și lichidă, polimerizează în rețele de rețele tridimensionale. Este un solid amorf în condiții normale și poate deveni cristalin și poate prezenta proprietăți metalice sub o presiune enormă..
Reprezintă o posibilă metodă de stocare a hidrogenului, fie ca sursă de hidrogen la descompunere, fie ca gaz solid absorbant. Cu toate acestea, BeHDouă este foarte toxic și poluant, având în vedere natura extrem de polarizantă a beriliului.
Indice articol
- 1 Structura chimică
- 1.1 Molecula BeH2
- 1.2 Lanțuri BeH2
- 1.3 Rețele tridimensionale ale BeH2
- 2 Proprietăți
- 2.1 Caracter covalent
- 2.2 Formula chimică
- 2.3 Aspect fizic
- 2.4 Solubilitatea în apă
- 2.5 Solubilitate
- 2.6 Densitate
- 2.7 Reactivitate
- 3 utilizări
- 4 Referințe
Structura chimică
Molecula BeHDouă
Prima imagine prezintă o singură moleculă de hidrură de beriliu în stare gazoasă. Rețineți că geometria sa este liniară, cu atomii H separați unul de altul de un unghi de 180º. Pentru a explica această geometrie, atomul Be trebuie să aibă hibridizare sp.
Beriliu are doi electroni de valență, care se află în orbitalul 2s. Conform teoriei legăturii de valență, unul dintre electronii din orbitalul 2s este promovat energetic către orbitalul 2p; și, în consecință, puteți forma acum două legături covalente cu cei doi orbitali hibrizi sp.
Și ce zici de restul orbitalilor liberi ai Be? Sunt disponibili alți doi orbitali 2p puri, nehibridizați. Cu ei goi, BeHDouă Este un compus cu deficit de electroni sub formă gazoasă; și, prin urmare, pe măsură ce moleculele sale se răcesc și se aglomerează, ele se condensează și cristalizează într-un polimer.
Lanțuri BeHDouă
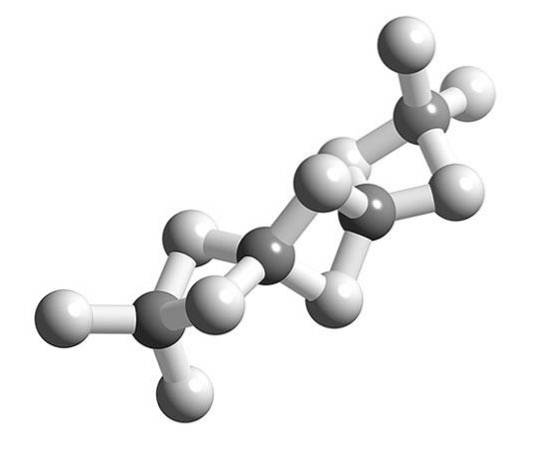
Când moleculele BeHDouă polimerizează, geometria înconjurătoare a atomului Be încetează să mai fie liniară și devine tetraedrică.
Anterior, structura acestui polimer a fost modelată ca și cum ar fi lanțuri cu unități BeHDouă legate prin legături de hidrogen (imaginea superioară, cu sferele în tonuri albe și cenușii). Spre deosebire de legăturile de hidrogen ale interacțiunilor dipol-dipol, acestea au un caracter covalent.
În puntea Be-H-Be a polimerului, doi electroni sunt distribuiți între cei trei atomi (link 3c, 2e), care teoretic ar trebui localizat cu o probabilitate mai mare în jurul atomului de hidrogen (fiind mai electronegativ).
Pe de altă parte, Be-ul înconjurat de patru H reușește să-și umple relativ vacanța electronică, completând octetul de valență.
Aici teoria legăturii de valență se estompează pentru a oferi o explicație relativ exactă. De ce? Deoarece hidrogenul poate avea doar doi electroni, iar legătura -H ar implica participarea a patru electroni.
Astfel, pentru a explica podurile Be-HDouă-Be (două sfere gri unite de două sfere albe) sunt necesare alte modele complexe ale legăturii, precum cele furnizate de teoria orbitalelor moleculare.
S-a constatat experimental că structura polimerică a BeHDouă nu de fapt un lanț, ci o rețea tridimensională.
Rețele tridimensionale ale BeHDouă

Imaginea superioară arată o secțiune a rețelei tridimensionale a BeHDouă. Rețineți că sferele verzi gălbui, atomii Be, formează un tetraedru ca în lanț; cu toate acestea, în această structură există un număr mai mare de legături de hidrogen și, în plus, unitatea structurală nu mai este BeHDouă dar BeH4.
Aceleași unități structurale BeHDouă și BeH4 indicați că există o abundență mai mare de atomi de hidrogen în rețea (4 atomi de H pentru fiecare Be).
Aceasta înseamnă că beriliul din această rețea reușește să-și asigure vacanța electronică chiar mai mult decât într-o structură polimerică asemănătoare unui lanț..
Și ca cea mai evidentă diferență a acestui polimer în raport cu molecula individuală de BeHDouă, este că Be trebuie neapărat să aibă o hibridizare sp3 (de obicei) pentru a explica geometriile tetraedrice și neliniare.
Proprietăți
Caracter covalent
De ce este hidrura de beriliu un compus covalent și neionic? Hidrurile celorlalte elemente din grupa 2 (domnul Becamgbara) sunt ionice, adică constau din solide formate dintr-un cation MDouă+ și doi anioni hidrură H- (MgHDouă, CaHDouă, BahDouă). Prin urmare, BeHDouă nu constă din BeDouă+ nici H- interacționând electrostatic.
Cationul BeDouă+ se caracterizează prin puterea sa mare de polarizare, care distorsionează norii electronici ai atomilor din jur.
Ca urmare a acestei distorsiuni, anionii H- sunt forțați să formeze legături covalente; link-uri, care sunt piatra de temelie a structurilor tocmai explicate.
Formula chimica
BeHDouă sau (BeHDouă) n
Aspectul fizic
Solid amorf incolor.
Solubilitatea apei
Se descompune.
Solubilitate
Insolubil în dietil eter și toluen.
Densitate
0,65 g / cm3 (1,85 g / L). Prima valoare se poate referi la faza gazoasă, iar a doua la solidul polimeric.
Reactivitate
Reacționează încet cu apa, dar este rapid hidrolizat de HCl pentru a forma clorură de beriliu, BeClDouă.
Hidrura de beriliu reacționează cu bazele Lewis, în special trimetilamina, N (CH3)3, pentru a forma un aduct dimeric, cu hidruri de punte.
De asemenea, poate reacționa cu dimetilamina pentru a forma diamidă de beriliu trimeric, [Be (N (CH3)Două)Două]3 și hidrogen. Reacția cu hidrură de litiu, unde ionul H- este baza Lewis, formează secvențial LIBeH3 și LiDouăBeH4.
Aplicații
Hidrura de beriliu ar putea reprezenta o modalitate promițătoare de stocare a hidrogenului molecular. Pe măsură ce polimerul se descompune, eliberează HDouă, care ar servi drept combustibil pentru rachete. Din această abordare, rețeaua tridimensională ar stoca mai mult hidrogen decât lanțurile.
La fel, după cum se poate vedea în imaginea rețelei, există pori care ar permite adăpostirea moleculelor H.Două.
De fapt, unele studii simulează cum ar arăta o astfel de stocare fizică în BeHDouă cristalin; adică polimerul supus unor presiuni enorme și care ar fi proprietățile sale fizice cu cantități diferite de hidrogen adsorbit.
Referințe
- Wikipedia. (2017). Hidrură de beriliu. Recuperat de pe: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Teoretic. Chim. Acta (1979) Structurile electronice ale hidrurii polimerice de beriliu și a hidrurii polimerice de bor. 51: 163. doi.org/10.1007/BF00554099
- Capitolul 3: Hidrura de beriliu și oligomerii săi. Recuperat de la: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger și U. P. Verma. (2014). Studiul comportamentului structural și electronic al BeHDouă ca compus de stocare a hidrogenului: o abordare Ab Initio. Conferințe în știință, vol. 2014, ID articol 807893, 5 pagini. doi.org/10.1155/2014/807893
- Shiver & Atkins. (2008). Chimie anorganică. În Elementele grupului 1. (ediția a patra). Mc Graw Hill.


Nimeni nu a comentat acest articol încă.