
Structura, proprietățile și utilizările hidroxidului de beriliu (Be (OH) 2)

hidroxid de beriliu Este un compus chimic format din două molecule de hidroxid (OH) și o moleculă de beriliu (Be). Formula sa chimică este Be (OH)Două și se caracterizează prin faptul că este o specie amfoteră. În general, poate fi obținut din reacția dintre monoxidul de beriliu și apă, conform următoarei reacții chimice: BeO + HDouăO → Be (OH)Două
Pe de altă parte, această substanță amfoteră are o configurație moleculară liniară. Cu toate acestea, din hidroxid de beriliu pot fi obținute diverse structuri: forma alfa și beta, ca mineral și în faza de vapori, în funcție de metoda utilizată..
Indice articol
- 1 Structura chimică
- 1.1 Hidroxid de alfa-beriliu
- 1.2 Hidroxid de beriliu beta
- 1.3 Hidroxid de beriliu în minerale
- 1.4 Vapori de hidroxid de beriliu
- 2 Proprietăți
- 2.1 Aspect
- 2.2 Proprietăți termochimice
- 2.3 Solubilitate
- 2.4 Riscuri de expunere
- 3 utilizări
- 4 Obținerea
- 4.1 Obținerea beriliu metalic
- 5 Referințe
Structura chimică
Acest compus chimic poate fi găsit în patru forme diferite:
Hidroxid de alfa-beriliu
Adăugarea oricărui reactiv bazic, cum ar fi hidroxid de sodiu (NaOH) la o soluție de sare de beriliu dă forma alfa (α) de hidroxid de beriliu. Un exemplu este prezentat mai jos:
2NaOH (diluat) + BeClDouă → Fii (OH)Două↓ + 2NaCl
2NaOH (diluat) + BeSO4 → Fii (OH)Două↓ + NaDouăSW4
Hidroxid de beriliu beta
Degenerarea acestui produs alfa formează o structură cristalină tetragonală meta-stabilă, care după o perioadă lungă de timp se transformă într-o structură rombică numită beta (β) hidroxid de beriliu..
Această formă beta se obține și ca precipitat dintr-o soluție de beriliu de sodiu prin hidroliză în condiții apropiate de punctul de topire..
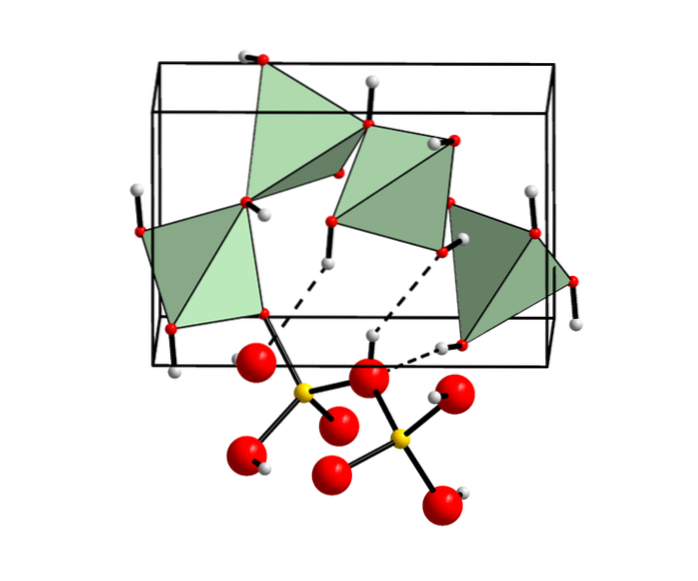
Hidroxid de beriliu în minerale
Deși nu este obișnuit, hidroxidul de beriliu se găsește ca un mineral cristalin cunoscut sub numele de behoit (numit în acest fel referindu-se la compoziția sa chimică).
Apare în pegmatite granitice formate prin alterarea Gadolinitei (minerale din grupul silicaților) în fumarolele vulcanice.
Acest mineral relativ nou a fost descoperit pentru prima dată în 1964, iar în prezent au fost găsite doar în pegmatite de granit situate în statele Texas și Utah din Statele Unite..
Vapor de hidroxid de beriliu
La temperaturi peste 1200 ° C (2190 ° C), hidroxidul de beriliu există în faza de vapori. Se obține din reacția dintre vaporii de apă și oxidul de beriliu (BeO).
În mod similar, vaporii rezultați au o presiune parțială de 73 Pa, măsurată la o temperatură de 1500 ° C..
Proprietăți
Hidroxidul de beriliu are o masă molară aproximativă sau o greutate moleculară de 43,0268 g / mol și o densitate de 1,92 g / cm3. Punctul său de topire este la o temperatură de 1000 ° C, la care începe descompunerea.
Ca mineral, Be (OH)Două (behoite) are o duritate de 4 și densitatea sa variază între 1,91 g / cm3 și 1,93 g / cm3.
Aspect
Hidroxidul de beriliu este un solid alb, care în forma sa alfa are un aspect gelatinos și amorf. Pe de altă parte, forma beta a acestui compus este constituită dintr-o structură cristalină bine definită, ortorombică și stabilă..
Se poate spune că morfologia mineralului Be (OH)Două este variat, deoarece poate fi găsit sub formă de cristale reticulare, arborescente sau agregate sferice. În același mod, vine în culori albe, roz, albăstrui și chiar incolore și cu un luciu vitros gras..
Proprietăți termochimice
Entalpia de formare: -902,5 kJ / mol
Energia Gibbs: -815,0 kJ / mol
Entropie de formare: 45,5 J / mol
Capacitate termică: 62,1 J / mol
Capacitate termică specifică: 1.443 J / K
Entalpia standard de formare: -20,98 kJ / g
Solubilitate
Hidroxidul de beriliu are caracter amfoter, deci este capabil să doneze sau să accepte protoni și se dizolvă atât în mediu acid, cât și în mediu bazic într-o reacție acido-bazică, producând sare și apă..
În acest sens, solubilitatea lui Be (OH)Două în apă este limitată de produsul de solubilitate Kps(H2O), care este egal cu 6,92 × 10-22.
Riscuri de expunere
Limita legală permisă de expunere umană (PEL sau OSHA) a unei substanțe hidroxid de beriliu definită pentru o concentrație maximă între 0,002 mg / m3 și 0,005 mg / m3 este de 8 ore și pentru o concentrație de 0,0225 mg / m3 un timp maxim de 30 de minute.
Aceste limitări se datorează faptului că beriliul este clasificat ca cancerigen de tip A1 (cancerigen uman, pe baza numărului de dovezi din studiile epidemiologice).
Aplicații
Utilizarea hidroxidului de beriliu ca materie primă pentru prelucrarea anumitor produse este foarte limitată (și neobișnuită). Cu toate acestea, este un compus utilizat ca principal reactiv pentru sinteza altor compuși și pentru obținerea beriliu metalic..
Obținerea
Oxidul de beriliu (BeO) este cel mai utilizat compus chimic de beriliu de înaltă puritate în industrie. Este caracterizat ca un solid incolor cu proprietăți de izolare electrică și conductivitate termică ridicată.
În acest sens, procesul de sinteză (în calitate tehnică) în industria primară se desfășoară după cum urmează:
- Hidroxidul de beriliu se dizolvă în acid sulfuric (HDouăSW4).
- Odată ce reacția este efectuată, soluția este filtrată, astfel încât să se elimine astfel impuritățile insolubile de oxid sau sulfat..
- Filtratul este supus evaporării pentru a concentra produsul, care este răcit pentru a obține cristale de sulfat de beriliu BeSO4.
- Sarutul4 calcine la o temperatură specifică cuprinsă între 1100 ° C și 1400 ° C.
Produsul final (BeO) este utilizat pentru fabricarea pieselor ceramice speciale pentru uz industrial..
Obținerea beriliu metalic
În timpul extracției și prelucrării mineralelor de beriliu, se generează impurități, cum ar fi oxidul de beriliu și hidroxidul de beriliu. Acesta din urmă este supus unei serii de transformări până la obținerea beriliului metalic.
Be (OH) reacționeazăDouă cu o soluție de bifluorură de amoniu:
Fii (OH)Două + 2 (NH4) HFDouă → (NH4)DouăBeF4 + 2 oreDouăSAU
(NH4)DouăBeF4 este supus unei creșteri a temperaturii, supusă descompunerii termice:
(NH4)DouăBeF4 → 2NH3 + 2HF + BeFDouă
În cele din urmă, reducerea fluorurii de beriliu la o temperatură de 1300 ° C cu magneziu (Mg) are ca rezultat beriliu metalic:
BeFDouă + Mg → Be + MgFDouă
Beriliu este utilizat în aliaje metalice, producția de componente electronice, fabricarea de ecrane și ferestre de radiații utilizate în mașinile cu raze X..
Referințe
- Wikipedia. (s.f.). Hidroxid de beriliu. Recuperat de pe en.wikipedia.org
- Holleman, A. F.; Wiberg, E. și Wiberg, N. (2001). Hidroxid de beriliu. Obținut din books.google.co.ve
- Editura, M. D. (s.f.). Behoite. Recuperat din handbookofmineralogy.org
- Toate reacțiile. (s.f.). Hidroxid de beriliu Be (OH)Două. Adus de pe allreactions.com
- PubChem. (s.f.). Hidroxid de beriliu. Recuperat de la pubchem.ncbi.nlm.nih.gov
- Walsh, K. A. și Vidal, E. E. (2009). Chimia și prelucrarea beriliului. Obținut din books.google.co.ve
Nimeni nu a comentat acest articol încă.