
Structura hidroxidului de mercur, proprietăți, utilizări, riscuri

hidroxid de mercur Este un compus anorganic în care mercurul metalic (Hg) are un număr de oxidare de 2+. Formula sa chimică este Hg (OH)Două. Cu toate acestea, această specie nu a fost încă obținută sub formă solidă în condiții normale..
Hidroxidul de mercur sau hidroxidul mercuric este un intermediar tranzitor de scurtă durată în formarea oxidului mercuric HgO în soluție alcalină. Din studiile efectuate în soluții de oxid mercuric HgO, s-a dedus că Hg (OH)Două este o bază slabă. Alte specii care îl însoțesc sunt HgOH+ iar HgDouă+.

În ciuda faptului că nu poate fi precipitat în soluție apoasă, Hg (OH)Două A fost obținut prin reacția fotochimică a mercurului cu hidrogen și oxigen la temperaturi foarte scăzute. De asemenea, a fost obținut sub formă de coprecipitat împreună cu Fe (OH)3, unde prezența ionilor de halogenură influențează pH-ul la care apare co-precipitarea.
Deoarece nu a fost ușor obținut pur la nivel de laborator, nu a fost posibil să se găsească nicio utilizare pentru acest compus și nici să se determine riscurile utilizării acestuia. Cu toate acestea, se poate deduce că prezintă aceleași riscuri ca și ceilalți compuși ai mercurului.
Indice articol
- 1 Structura moleculei
- 2 Configurare electronică
- 3 Nomenclatură
- 4 Proprietăți
- 4.1 Greutate moleculară
- 4.2 Proprietăți chimice
- 5 Obținerea
- 5.1 Hidroxid de mercur pur
- 5.2 Co-precipitarea cu hidroxid de fier (III)
- 6 utilizări
- 7 Studii recente
- 8 Riscuri
- 9 Referințe
Structura moleculei
Structura hidroxidului de mercur (II) Hg (OH)Două se bazează pe o porțiune liniară centrală formată din atomul de mercur cu cei doi atomi de oxigen pe laturi.
La această structură centrală sunt atașați atomi de hidrogen, fiecare lângă fiecare oxigen, care se rotesc liber în jurul fiecărui oxigen. Ar putea fi reprezentat într-un mod simplu după cum urmează:
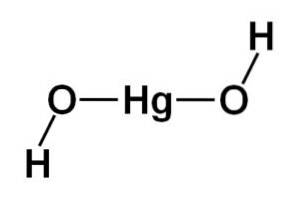
Configurare electronică
Structura electronică a mercurului metalic Hg este după cum urmează:
[Xe] 5d10 6sDouă
unde [Xe] este configurația electronică a xenonului cu gaz nobil.
La observarea acestei structuri electronice, se derivă faptul că cea mai stabilă stare de oxidare a mercurului este cea în care se pierd cei 2 electroni ai stratului 6.s.
În hidroxidul mercuric Hg (OH)Două, atomul de mercur (Hg) se află în starea sa de oxidare de 2+. Prin urmare, în Hg (OH)Două mercurul are următoarea configurație electronică:
[Xe] 5d10
Nomenclatură
- Hidroxid de mercur (II)
- Hidroxid de mercur
- Dihidroxid de mercur
Proprietăți
Greutate moleculară
236,62 g / mol
Proprietăți chimice
Conform informațiilor consultate, este posibil ca Hg (OH)Două să fie un compus tranzitoriu în formarea HgO în mediu apos alcalin.
Adăugarea de ioni hidroxil (OH-) la o soluție apoasă de ioni mercurici HgDouă+ duce la precipitarea unui solid galben de oxid de mercur (II) HgO, din care Hg (OH)Două este agent temporar sau temporar.

În soluție apoasă Hg (OH)Două Este un intermediar de foarte scurtă durată, deoarece eliberează rapid o moleculă de apă și precipită HgO solid.
Deși nu a fost posibilă precipitarea hidroxidului mercuric Hg (OH)Două, oxidul de mercur (II) HgO este oarecum solubil în apă, formând o soluție a speciilor numite „hidroxizi”.
Aceste specii din apă numite „hidroxizi” sunt baze slabe și, deși uneori se comportă ca amfotere, în general Hg (OH)Două este mai bazic decât acidul.
Când HgO se dizolvă în HClO4 studiile indică prezența ionului mercuric HgDouă+, un ion monohidroximercuric HgOH+ și hidroxid de mercur Hg (OH)Două.
Echilibrele care apar în astfel de soluții apoase sunt următoarele:
HgDouă+ + HDouăO ⇔ HgOH+ + H+
HgOH+ + HDouăO ⇔ Hg (OH)Două + H+
În soluțiile alcaline de NaOH se formează specia Hg (OH)3-.
Obținerea
Hidroxid de mercur pur
Hidroxid de mercur (II) Hg (OH)Două Nu poate fi obținut în soluție apoasă, deoarece la adăugarea de alcali la o soluție de ioni mercurici HgDouă+, se precipită oxidul mercuric galben HgO.
Cu toate acestea, unii cercetători au reușit să obțină hidroxid de mercur Hg (OH) pentru prima dată în 2005Două folosind o lampă cu arc de mercur, începând de la elementul mercur Hg, hidrogen HDouă și oxigenul ODouă.

Reacția este fotochimică și a fost efectuată în prezența unui neon solid, argon sau deuteriu la temperaturi foarte scăzute (în jur de 5 K = 5 grade Kelvin). Dovada formării compușilor a fost obținută prin spectre de absorbție a luminii IR (infraroșu).
Hg (OH)Două pregătit în acest fel este foarte stabil în condițiile experienței. Se estimează că reacția fotochimică se desfășoară prin intermediarul O-Hg-O către molecula stabilă H-O-Hg-O-H.
Coprecipitare cu hidroxid de fier (III)
Dacă sulfatul de mercur (II) HgSO se dizolvă4 și sulfat de fier (III) FeDouă(SW4)3 în soluție apoasă acidă, iar pH-ul începe să crească prin adăugarea unei soluții de hidroxid de sodiu NaOH, după un timp de repaus se formează un solid care se deduce a fi un co-precipitat de Hg (OH)Două și Fe (OH)3.
S-a constatat că formarea Hg (OH)Două este un pas critic în această co-precipitare cu Fe (OH)3.
Formarea Hg (OH)Două în precipitatul Fe (OH)3-Hg (OH)Două depinde puternic de prezența ionilor precum fluor, clorură sau bromură, de concentrația lor specifică și de pH-ul soluției.
În prezența fluorurii (F-), la pH mai mare de 5, coprecipitarea Hg (OH)Două cu Fe (OH)3 nu este afectat. Dar la un pH de 4 formarea complexelor între HgDouă+ iar F- interferează cu co-precipitarea Hg (OH)Două.
În cazul prezenței clorurii (Cl-), co-precipitarea Hg (OH)Două apare la un pH de 7 sau mai mare, adică de preferință într-un mediu alcalin.
Când bromură (Br-), co-precipitarea Hg (OH)Două are un pH chiar mai mare, adică pH peste 8,5 sau mai alcalin decât cu clorura.
Aplicații
Din analiza surselor de informații disponibile se deduce că hidroxidul de mercur (II) Hg (OH)Două, Fiind un compus care nu a fost încă preparat comercial, nu are utilizări cunoscute.
Studii recente
Folosind tehnici de simulare computațională în 2013, au fost studiate caracteristicile structurale și energetice legate de hidratarea Hg (OH).Două într-o stare gazoasă.
Au fost calculate și comparate energiile de coordonare și solvatare metal-ligand și comparate prin variația gradului de hidratare a Hg (OH)Două.
Printre altele, s-a constatat că aparent starea teoretică de oxidare este 1+ în loc de presupusa 2+ atribuită de obicei pentru Hg (OH)Două.
Riscuri
Deși Hg (OH)Două ca atare, nu a fost izolat în cantitate suficientă și, prin urmare, nu a fost utilizat comercial, riscurile sale specifice nu au fost determinate, dar se poate deduce că prezintă aceleași riscuri ca și restul sărurilor de mercur.
Poate fi toxic pentru sistemul nervos, sistemul digestiv, pielea, ochii, sistemul respirator și rinichii..
Inhalarea, ingestia sau contactul cu pielea a compușilor cu mercur pot provoca leziuni, de la iritarea ochilor și a pielii, insomnie, dureri de cap, tremurături, leziuni ale tractului intestinal, pierderi de memorie, insuficiență renală, printre alte simptome.
Mercurul a fost recunoscut la nivel internațional ca poluant. Majoritatea compușilor cu mercur care intră în contact cu mediul sunt metilați de bacterii prezente în soluri și sedimente, formând metilmercur.
Acest compus se bioacumulează în organismele vii, trecând de la sol la plante și de acolo la animale. În mediul acvatic transferul este chiar mai rapid, trecând de la specii foarte mici la specii mari într-un timp scurt.
Metilmercurul are un efect toxic pentru ființele vii și în special pentru oameni, care îl ingerează prin lanțul trofic.
Când este ingerat cu alimente, este deosebit de dăunător pentru copiii mici și pentru fături la femeile gravide, deoarece fiind neurotoxină poate provoca leziuni ale creierului și ale sistemului nervos în formare și creștere..
Referințe
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Wang, Xuefeng și Andrews, Lester (2005). Spectrul infraroșu al Hg (OH)Două în Solid Neon și Argon. Chimie anorganică, 2005, 44, 108-113. Recuperat de la pubs.acs.org.
- Amaro-Estrada, J.I. și colab. (2013). Solvarea apoasă a Hg (OH)Două: Studii teoretice funcționale ale densității energetice și dinamice ale Hg (OH)Două-(HDouăSAU)n (n = 1-24) Structuri. J. Phys. Chem. A 2013, 117, 9069-9075. Recuperat de la pubs.acs.org.
- Inoue, Yoshikazu și Munemori, Makoto. (1979). Coprecipitarea mercurului (II) cu hidroxidul de fier (III). Știința și tehnologia mediului. Volumul 13, numărul 4, aprilie 1979. Recuperat de la pubs.acs.org.
- Chang, L.W., și colab. (2010). Sistemul nervos și toxicologia comportamentală. În Toxicologie cuprinzătoare. Recuperat de la sciencedirect.com.
- Haney, Alan și Lipsey, Richard L. (1973). Acumularea și efectele hidroxidului de metil mercur într-un lanț alimentar terestru în condiții de laborator. Mediu Poluează. (5) (1973) pp. 305-316. Recuperat de la sciencedirect.com.



Nimeni nu a comentat acest articol încă.