
Structura hidroxidului de sodiu (NaOH), proprietăți, utilizări, sinteză

hidroxid de sodiu Este un compus anorganic a cărui formulă chimică este NaOH și constă dintr-o bază metalică foarte puternică sau alcalină. O soluție de 5% în apă are un pH apropiat de 14.
Este un solid alb foarte higroscopic care poate absorbi și dioxidul de carbon din aer pentru a forma carbonat de sodiu. Se comercializează în sticle de plastic sub formă de pastile, care nu pot fi expuse prea mult timp la aer și nici nu trebuie manipulate cu spatule.

Hidroxidul de sodiu poate fi sintetizat prin reacția hidroxidului de calciu cu carbonatul de sodiu. În prezent, însă, este sintetizat fundamental prin electroliza saramurii și este un produs secundar al producției de clor gazos.
Având în vedere elementul de bază ridicat al NaOH, acesta are numeroase utilizări și aplicații, precum producția de hârtie, săpunuri, detergenți, coloranți etc. Este, de asemenea, utilizat în curățarea gospodăriei, tratarea apei, prelucrarea aluminiului, fabricarea medicamentelor etc.; și mai presus de toate, este un model secundar prin excelență.
Hidroxidul de sodiu este foarte coroziv, fiind capabil să provoace iritații și arsuri pe piele și ochi. Inhalând praful său, poate provoca edem pulmonar. Între timp, ingestia sa poate provoca leziuni atât de grave ale tractului digestiv, încât poate duce la moarte..
Indice articol
- 1 Structură
- 1.1 Anhidru
- 1.2 Hidrați
- 2 Proprietăți fizice și chimice
- 2.1 Denumiri
- 2.2 Masa molară
- 2.3 Aspect
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Solubilitatea în apă
- 2.7 Basicitate (pKb)
- 2,8 pH
- 2.9 Indicele de refracție (nD)
- 2.10 Stabilitate
- 2.11 Descompunerea
- 2.12 Punct de autoaprindere
- 2.13 Vâscozitatea
- 2.14 Căldura de vaporizare
- 2.15 Tensiunea superficială
- 2.16 Reactivitate
- 3 Sinteza
- 3.1 Reacția carbonatului de sodiu și a hidroxidului de calciu
- 3.2 Electroliza clorurii de sodiu
- 4 utilizări
- 4.1 Produse de curățare
- 4.2 Produse farmaceutice și medicamentoase
- 4.3 Procese energetice
- 4.4 Tratarea apei
- 4.5 Fabricarea hârtiei
- 4.6 Fabricarea industrială
- 5 Riscuri
- 6 Referințe
Structura
Anhidru

Imaginea superioară arată ionii care alcătuiesc NaOH. Cationul Na+ este reprezentat de sfera mov, în timp ce anionul hidroxil (hidroxid sau hidroxil) OH- de sfera roșie și albă. Ambii ioni Na+ și OH- interacționează între ele prin atracția electrostatică a sarcinilor lor opuse.
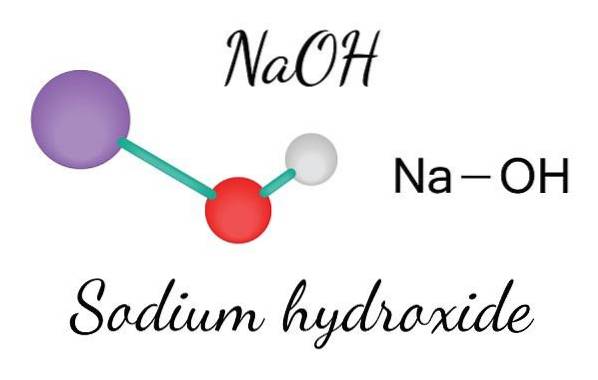
Astfel de interacțiuni sunt nondirecționale, deci atracțiile unei perechi de ioni Na+Oh- le poate afecta pe ale altora la o anumită distanță. Rezultatul este că ionii de Na+ respingeți reciproc, în același mod în care OH-, până la definirea unui cristal de energie minimă în care stabilesc o structură ordonată și periodică (cristalină).
Prin urmare, apar cristalele ortorombice de NaOH anhidru (fără apă):
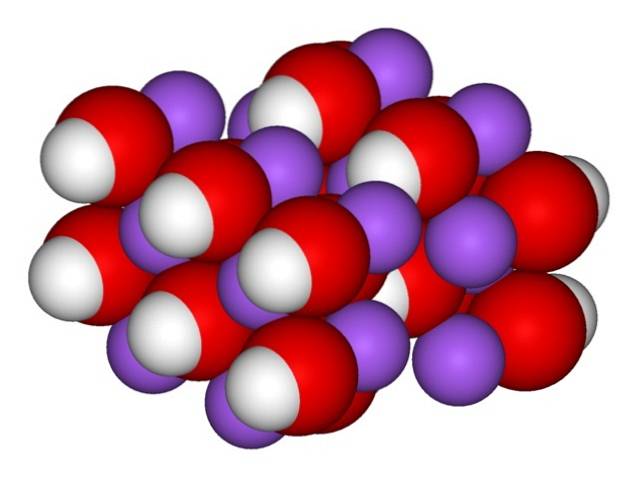
Ionii rămân suficient de coeziți astfel încât cristalul NaOH anhidru să se topească la 323 ° C (atâta timp cât nu există umiditate în mediu).
Hidratați
Atât Na+ ca OH- Sunt ioni pe care moleculele de apă le solvatează ușor (hidratează). Acest lucru favorizează hidratarea sa deasupra energiei reticulare a cristalelor sale, motiv pentru care NaOH eliberează multă energie când intră în contact cu apa..
Cu toate acestea, cristalele anhidre pot găzdui molecule de apă nedizolvate; adică hidroxidul de sodiu poate forma numeroși hidrați, NaOH nHDouăO. Molecula de apă poate forma o legătură de hidrogen cu OH- (HOH-OH-), sau coordonați cu Na+ (N / A+-OhDouă).
În funcție de raportul molar dintre NaOH și HDouăSau, monohidrați (NaOHHDouăO), dihidrați (NaOH 2HDouăO), trihemidrati (NaOH 3,5HDouăO), tetrahidrați (NaOH 4HDouăO), heptahidrați (NaOH 7HDouăO) și multe altele.
Fiecare dintre acești hidrați poate cristaliza dintr-o soluție apoasă de NaOH cu procente diferite de masă și la temperaturi diferite. În consecință, NaOH prezintă o diagramă complicată de solubilitate în apă..
În termeni generali, cristalele de hidrați sunt mai puțin dense și au puncte de topire mai mici. Acest lucru se datorează faptului că moleculele de apă „împiedică” interacțiunile dintre Na+ și OH-, adăugând forțe dipol-dipol la sacrificiul atracțiilor ionice.
Proprietati fizice si chimice
Numele
Denumirea preferată de IUPAC: hidroxid de sodiu. Alte denumiri: Soda caustică, Ascarit (mai puțin frecvent)
Masă molară
39,9971 g / mol
Aspect
Solid sau cristale albe, seroase sau opace.
Punct de topire
323 ºC
Punct de fierbere
1.388 ºC
Solubilitatea apei
1.000 g / L la o temperatură de 25 ° C. Aceasta arată cât de mult se poate dizolva în apă..
Soluțiile lor apoase sunt vâscoase, cu o valoare a vâscozității de aproximativ optzeci de ori mai mare decât a apei, și eliberează multă căldură la început. Dacă aveți contact cu ei, acestea fac pielea alunecoasă, datorită saponificării acizilor grași din piele..
Basicitate (pKb)
- 0,56
pH
O soluție de 5% g / g în apă are un pH apropiat de 14
Indicele de refracție (nD)
La o lungime de undă de 580,4 nm: 1.433 la 320 ºC și 1.421 la 420 ºC.
Stabilitate
Recipientele care îl conțin trebuie să fie închise ermetic pentru a preveni formarea carbonatului de sodiu. Acest lucru se datorează higroscopicității sale ridicate, care îl determină să absoarbă umezeala din mediul înconjurător și conținutul său de CO.Două.
Descompunere
Când este încălzit până la descompunere, emite fum de oxid de sodiu.
Punct de autoaprindere
Nu este inflamabil
Viscozitate
4,0 cPoise la 350 ºC
Căldura de vaporizare
175 kJ / mol la 1.388 ºC
Tensiune de suprafata
74,35 dynes / cm într-o soluție de 2,72% g / g în apă la 18 ° C.
Reactivitate
Cu acizi
Reacționează cu acizi minerali organici și anorganici, creând apă și sarea corespunzătoare. În cazul acidului sulfuric reacția este exotermă.
2 NaOH + HDouăSW4 => NaDouăSW4 + 2 oreDouăSAU
Cu oxizi acizi
Reacționează cu dioxidul de sulf, de exemplu, dând o sare de sulfit și apă:
2 NaOH + SODouă => NaDouăSW3 + HDouăSAU
Cu metale
Soluțiile sale apoase reacționează cu unele metale pentru a produce săruri de sodiu complexe. De exemplu, reacția sa cu zinc dă naștere unui zincat de sodiu:
Zn + 2 NaOH + 2 HDouăO => NaDouă[Zn (OH)4] + HDouă
Sinteză
Hidroxidul de sodiu este sintetizat în principal prin două metode: utilizarea carbonatului de sodiu, utilizat inițial, și electroliza clorurii de sodiu, în prezent în uz industrial mai mare..
Reacția carbonatului de sodiu și a hidroxidului de calciu
Carbonatul de sodiu reacționează cu hidroxidul de calciu într-un proces cunoscut sub numele de causticizare:
Ca (OH)Două + N / ADouăCO3 => CaCO3 + NaOH
Carbonatul de calciu precipită, lăsând hidroxidul de sodiu în supernatant, care este concentrat prin evaporare.
Carbonatul de sodiu provine anterior din procesul Solvay:
2 NaCI + CaCO3 => NaDouăCO3 + CaClDouă
Electroliza clorurii de sodiu
Electroliza clorurii de sodiu, prezentă în saramură, produce hidrogen gazos, clorură gazoasă și hidroxid de sodiu în soluție apoasă:
2 Nacl + 2 HDouăO => HDouă + ClDouă + 2 NaOH
Camera electrolitică este formată dintr-un compartiment în care se află anodul (+), realizat din metal de titan și un loc în care este plasată saramura. Acest compartiment este separat de compartimentul catodic (-) printr-o membrană poroasă..
Următoarea reacție are loc la anod:
2 Cl- => ClDouă + 2 e- (oxidare)
Între timp, această reacție are loc la catod:
2 oreDouăO + 2 e- => HDouă + Oh- (reducere)
Sodiu (Na+) difuzează din compartimentul anodic în compartimentul catodic, prin membrana care le separă, formând hidroxid de sodiu.
Aplicații
Produse de curatat
Hidroxidul de sodiu este utilizat pentru fabricarea săpunurilor și detergenților utilizați în casă și în afaceri. Combinația de hidroxid de sodiu și clor produce înălbitor cu clor, utilizat la spălarea hainelor albe.
De asemenea, elimină acumularea de grăsime în canalele de scurgere, producând eliminarea acesteia prin conversia sa în săpunuri prin procesul de saponificare. Acest lucru permite eliminarea blocajului conductelor caselor și a altor clădiri.
Produse farmaceutice și medicinale
Hidroxidul de sodiu este utilizat pentru a produce analgezice obișnuite, cum ar fi aspirina. De asemenea, de medicamente cu acțiune anticoagulantă care blochează formarea de cheaguri de sânge și medicamente pentru a reduce hipercolesterolemia.
Procese energetice
Hidroxidul de sodiu este utilizat la fabricarea celulelor de combustibil care funcționează ca bateriile pentru a produce electricitate pentru o varietate de aplicații, inclusiv pentru transport. Rășinile epoxidice, fabricate cu intervenția hidroxidului de sodiu, sunt utilizate în turbine eoliene.
Tratamentul apei
Hidroxidul de sodiu este utilizat pentru a neutraliza aciditatea apei și a contribui la îndepărtarea metalelor grele din ea. Este, de asemenea, utilizat pentru producerea de hipoclorit de sodiu, un dezinfectant pentru apă.
Hidroxidul de sodiu reacționează cu sulfatul de aluminiu pentru a forma hidroxid de aluminiu: un agent de floculare care este utilizat în stațiile de tratare a apei pentru a crește sedimentarea particulelor, producând clarificarea lor..
Fabricarea hârtiei
Hidroxidul de sodiu este utilizat cu sulfura de sodiu în tratamentul lemnului pentru obținerea celulozei, într-o formă aproape pură, care stă la baza hârtiei. Este, de asemenea, utilizat la reciclarea hârtiei, deoarece, ajutând la separarea cernelii, permite utilizarea sa din nou.
Fabricare industrială
Hidroxidul de sodiu este utilizat la fabricarea raionului, spandexului, explozivilor, rășinilor epoxidice, sticlei și ceramicii. Se folosește în industria textilă pentru fabricarea coloranților și prelucrarea țesăturilor de bumbac.
În stațiile de tratare a trestiei de zahăr, hidroxidul de sodiu la temperatură scăzută este utilizat pentru producerea etanolului din baga de trestie de zahăr.
Riscuri
Hidroxidul de sodiu este un compus extrem de coroziv, deci poate provoca, prin contactul cu pielea, arsuri, vezicule și chiar cicatrici permanente.
În contact cu ochii, poate provoca arsuri severe, umflături, durere, vedere încețoșată și, în cazuri severe, poate provoca orbire permanentă..
Înghițirea hidroxidului de sodiu poate provoca arsuri la nivelul buzelor, limbii, gâtului, esofagului și stomacului. Simptomele frecvente includ greață, vărsături, crampe stomacale și diaree..
Deși inhalarea hidroxidului de sodiu este rară și poate apărea numai datorită prezenței prafului compusului în aer sau a formării unei cețe care îl conține, produce iritații în plămâni..
În cazul expunerii cronice, aceasta poate provoca edem pulmonar și dificultăți severe de respirație, care constituie o urgență medicală..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Hidroxid de sodiu. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Hidroxid de sodiu. Baza de date PubChem. CID = 14798. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Elemente americane. (2019). Soluție de hidroxid de sodiu. Recuperat de pe: americanelements.com
- Fapte de siguranță chimică. (2019). Hidroxid de sodiu. Recuperat de la: chemicalafetyfacts.org
- NJ Health. (2015). Hidroxid de sodiu. [PDF]. Recuperat de la: nj.gov
- Centrul canadian pentru sănătate și securitate la locul de muncă. (2019). Fișe informative despre răspunsurile la SST: hidroxid de sodiu. Recuperat de la: ccohs.ca
- Ausetute. (s.f.). Hidroxid de sodiu și producție de clor prin electroliză. Recuperat de pe: ausetute.com.au



Nimeni nu a comentat acest articol încă.