
Proprietăți de hidroxid, nomenclatură și exemple

hidroxizi sunt compuși anorganici și ternari care constau în interacțiunea dintre un cation metalic și grupa funcțională OH (anion hidroxid, OH-). Majoritatea sunt de natură ionică, deși pot avea și legături covalente.
De exemplu, un hidroxid poate fi reprezentat ca interacțiune electrostatică între cationul M+ și anionul OH-, sau ca legătură covalentă prin legătura M-OH (imagine inferioară). În prima, legătura ionică apare, în timp ce în a doua, covalenta. Acest fapt depinde în esență de metalul sau cationul M+, precum și sarcina și raza sa ionică.
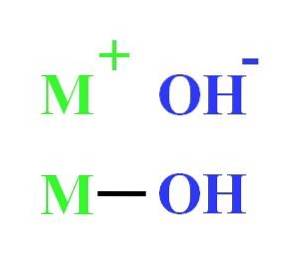
Deoarece majoritatea provin din metale, este echivalent să le menționăm ca hidroxizi metalici.
Indice articol
- 1 Cum sunt formate?
- 2 Proprietățile hidroxizilor
- 2.1 Anion OH-
- 2.2 Caracterul ionic și de bază
- 2.3 Tendință periodică
- 2.4 Amfotericism
- 2.5 Structuri
- 2.6 Reacția de deshidratare
- 3 Nomenclatură
- 3.1 Tradițional
- 3.2 Stoc
- 3.3 Sistematică
- 4 Exemple de hidroxizi
- 5 Referințe
Cum sunt formate?
Există două căi sintetice principale: prin reacția oxidului corespunzător cu apă sau cu o bază puternică într-un mediu acid:
MO + HDouăO => M (OH)Două
MO + H+ + Oh- => M (OH)Două
Doar acei oxizi metalici solubili în apă reacționează direct pentru a forma hidroxidul (prima ecuație chimică). Altele sunt insolubile și necesită specii acide pentru a elibera M+, care apoi interacționează cu OH- din baze puternice (a doua ecuație chimică).
Cu toate acestea, aceste baze puternice sunt hidroxizi metalici NaOH, KOH și alții din grupul metalelor alcaline (LiOH, RbOH, CsOH). Aceștia sunt compuși ionici foarte solubili în apă, de unde și OH- sunt liberi să participe la reacții chimice.
Pe de altă parte, există hidroxizi metalici care sunt insolubili și, în consecință, sunt baze foarte slabe. Unele dintre ele sunt chiar acide, cum este cazul acidului teluric, Te (OH)6.
Hidroxidul stabilește un echilibru de solubilitate cu solventul din jur. Dacă este apă, de exemplu, atunci echilibrul se exprimă după cum urmează:
M (OH)Două <=> MDouă+(ac) + OH-(ac)
Unde (ac) denotă faptul că mediul este apos. Când solidul este insolubil, concentrația de OH dizolvată este mică sau neglijabilă. Din acest motiv, hidroxizii metalici insolubili nu pot genera soluții la fel de bazice ca NaOH..
Din cele de mai sus se poate deduce că hidroxizii prezintă proprietăți foarte diferite, legate de structura chimică și de interacțiunile dintre metal și OH. Astfel, deși multe sunt ionice, cu structuri cristaline variate, altele au structuri polimerice complexe și dezordonate..
Proprietățile hidroxizilor
OH anion-
Ionul hidroxil este un atom de oxigen legat covalent de hidrogen. Astfel, acest lucru poate fi ușor reprezentat ca OH-. Sarcina negativă este localizată pe oxigen, făcând din acest anion o specie donatoare de electroni: o bază.
Dacă OH- își donează electronii unui hidrogen, se formează o moleculă de HDouăO. De asemenea, puteți dona electronii dvs. speciilor încărcate pozitiv: cum ar fi centrele metalice M+. Astfel, se formează un complex de coordonare prin legătura dativă M-OH (oxigenul furnizează perechea de electroni).
Cu toate acestea, pentru ca acest lucru să se întâmple, oxigenul trebuie să fie capabil să se coordoneze eficient cu metalul, altfel interacțiunile dintre M și OH vor avea un caracter ionic marcat (M+ Oh-). Deoarece ionul hidroxil este același în toți hidroxizii, diferența dintre toți se află atunci în cationul care îl însoțește.
De asemenea, deoarece acest cation poate proveni din orice metal de pe tabelul periodic (grupele 1, 2, 13, 14, 15, 16 sau metalele de tranziție), proprietățile unor astfel de hidroxizi variază enorm, deși toate contemplă în comun unele aspecte.
Caracter ionic și de bază
În hidroxizi, deși au legături de coordonare, au un caracter ionic latent. La unii, cum ar fi NaOH, ionii lor fac parte dintr-o rețea de cristal formată din cationi Na+ și anioni OH- în proporții 1: 1; adică pentru fiecare ion Na+ există un ion OH- echivalent.
În funcție de încărcarea metalului, vor exista mai mulți sau mai puțini anioni OH- în jurul ei. De exemplu, pentru un cation metalic MDouă+ vor exista doi ioni OH- interacționând cu el: M (OH)Două, ceea ce este schițat ca HO- MDouă+ Oh-. La fel se întâmplă cu metalele M3+ și cu alții cu sarcini mai pozitive (deși rareori depășesc 3+).
Acest caracter ionic este responsabil pentru multe dintre proprietățile fizice, cum ar fi punctele de topire și fierbere. Acestea sunt mari, reflectând forțele electrostatice care funcționează în interiorul rețelei de cristal. La fel, atunci când hidroxizii se dizolvă sau se topesc, pot conduce curent electric datorită mobilității ionilor lor..
Cu toate acestea, nu toți hidroxizii au aceleași rețele cristaline. Cei cu cei mai stabili vor fi mai puțin probabil să se dizolve în solvenți polari, cum ar fi apa. De regulă, cu atât razele ionice ale lui M sunt mai disparate+ și OH-, mai solubil va fi la fel.
Tendință periodică
Acest lucru explică de ce solubilitatea hidroxizilor metalelor alcaline crește pe măsură ce se trece în jos în grup. Astfel, ordinea crescândă a solubilităților în apă pentru acestea este următoarea: LiOH OH- este un anion mic și, pe măsură ce cationul devine mai voluminos, rețeaua cristalină slăbește energetic. Pe de altă parte, metalele alcalino-pământoase formează hidroxizi mai puțin solubili datorită încărcărilor lor pozitive mai mari. Acest lucru se datorează faptului că MDouă+ atrage OH mai puternic- comparativ cu M+. În mod similar, cationii săi sunt mai mici și, prin urmare, sunt mai puțin inegali ca mărime în ceea ce privește OH-. Rezultatul este o dovadă experimentală că NaOH este mult mai bazic decât Ca (OH).Două. Același raționament poate fi aplicat și pentru alți hidroxizi, fie pentru cei ai metalelor de tranziție, fie pentru cei ai metalelor blocului p (Al, Pb, Te etc.). De asemenea, cu cât raza ionică și sarcina pozitivă a lui M sunt mai mici și mai mari+, cu atât caracterul ionic al hidroxidului este mai mic, cu alte cuvinte, cele cu densități de încărcare foarte mari. Un exemplu în acest sens apare cu hidroxidul de beriliu, Be (OH)Două. El să fieDouă+ este un cation foarte mic și încărcătura sa bivalentă îl face foarte dens din punct de vedere electric. Hidroxizi M (OH)Două reacționează cu acizi pentru a forma un complex apos, adică M+ ajunge înconjurat de molecule de apă. Cu toate acestea, există un număr limitat de hidroxizi care pot reacționa și cu baze. Acestea sunt cele cunoscute sub numele de hidroxizi amfoterici. Hidroxizii amfoterici reacționează atât cu acizi, cât și cu baze. A doua situație poate fi reprezentată de următoarea ecuație chimică: M (OH)Două + Oh- => M (OH)3- Dar cum să stabilim dacă un hidroxid este amfoteric? Printr-un simplu experiment de laborator. Deoarece mulți hidroxizi metalici sunt insolubili în apă, adăugând o bază puternică unei soluții cu ionii M.+ dizolvat, de exemplu, Al3+, hidroxidul corespunzător va precipita: Pentru3+(aq) + 3OH-(ac) => Al (OH)3(s) Dar având un exces de OH- hidroxidul continuă să reacționeze: Al (OH)3(s) + OH- => Al (OH)4-(ac) Ca rezultat, noul complex încărcat negativ este solvatat de moleculele de apă din jur, dizolvând solidul hidroxid de aluminiu alb. Acei hidroxizi care rămân neschimbați cu adăugarea suplimentară de bază nu se comportă ca acizi și, prin urmare, nu sunt amfoteri. Hidroxizii pot avea structuri cristaline similare cu cele ale multor săruri sau oxizi; unele simple, iar altele foarte complexe. În plus, cei în care există o scădere a caracterului ionic pot prezenta centre metalice legate de punți de oxigen (HOM-O-MOH). În soluție structurile sunt diferite. Deși pentru hidroxizii foarte solubili este suficient să-i considerăm ca ioni dizolvați în apă, pentru alții este necesar să se țină seama de chimia coordonării. Astfel, fiecare cation M+ poate fi coordonat la un număr limitat de specii. Cu cât este mai voluminoasă, cu atât este mai mare numărul de molecule de apă sau OH.- legat de acesta. De aici vine celebrul octaedru de coordonare a multor metale dizolvate în apă (sau în orice alt solvent): M (OHDouă)6+n, unde n este egal cu sarcina pozitivă a metalului. Cr (OH)3, de exemplu, formează de fapt un octaedru. Cum? Considerând compusul ca [Cr (OHDouă)3(OH)3], dintre care trei dintre moleculele de apă sunt înlocuite cu anioni OH-. Dacă toate moleculele ar fi înlocuite cu OH-, apoi complexul cu sarcină negativă și structură octaedrică [Cr (OH)6]3-. Taxa -3 este rezultatul celor șase taxe negative ale OH-. Hidroxizii pot fi considerați ca „oxizi hidrați”. Cu toate acestea, în ele „apa” este în contact direct cu M+; în timp ce în oxizii hidratați MO nHDouăSau, moleculele de apă fac parte dintr-o sferă de coordonare externă (nu sunt aproape de metal). Aceste molecule de apă pot fi extrase prin încălzirea unei probe de hidroxid: M (OH)Două + Q (căldură) => MO + HDouăSAU MO este oxidul metalic format ca urmare a deshidratării hidroxidului. Un exemplu al acestei reacții este cel observat atunci când hidroxidul cupric, Cu (OH), este deshidratatDouă: Cu (OH)Două (albastru) + Q => CuO (negru) + HDouăSAU Care este modul adecvat de a menționa hidroxizii? IUPAC a propus trei nomenclatoare în acest scop: tradițional, stoc și sistematic. Este corect să folosiți oricare dintre cele trei, cu toate acestea, pentru unii hidroxizi poate fi mai convenabil sau practic să-l menționați într-un fel sau altul. Nomenclatura tradițională este pur și simplu să adauge sufixul -ico la cea mai înaltă valență a metalului; iar sufixul -oso la cel mai mic. Astfel, de exemplu, dacă metalul M are valențe +3 și +1, hidroxidul M (OH)3 se va numi hidroxid (denumire metalică)ico, în timp ce hidroxidul MOH (denumirea metalului)urs. Pentru a determina valența metalului din hidroxid, trebuie doar să ne uităm la numărul de după OH cuprins între paranteze. Astfel, M (OH)5 înseamnă că metalul are o sarcină sau o valență de +5. Principalul dezavantaj al acestei nomenclaturi este că poate fi complicat pentru metalele cu mai mult de două stări de oxidare (cum ar fi cromul și manganul). Pentru astfel de cazuri, prefixele hiper- și hipo- sunt utilizate pentru a desemna cele mai mari și cele mai mici valențe.. Astfel, dacă M în loc să aibă doar +3 și +1 valențe, are și +4 și +2, atunci numele hidroxizilor săi cu cele mai mari și mai mici valențe sunt: hidroxid hiper(nume metalic)ico, și hidroxid sughiţ(nume metalic)urs. Dintre toate nomenclaturile, aceasta este cea mai simplă. Aici numele hidroxidului este pur și simplu urmat de valența metalului închis între paranteze și scris cu cifre romane. Din nou pentru M (OH)5, de exemplu, nomenclatura stocului dvs. ar fi: (denumirea metalului) hidroxid (V). (V) denotă atunci (+5). În cele din urmă, nomenclatura sistematică se caracterizează prin recurgerea la multiplicarea prefixelor (di-, tri-, tetra-, penta-, hexa- etc.). Aceste prefixe sunt utilizate pentru a specifica atât numărul de atomi de metal, cât și ioni OH.-. În acest fel, M (OH)5 denumit ca: (denumirea metalului) pentahidroxid. În cazul HgDouă(OH)Două, de exemplu, ar fi dihidroxid dimercuric; unul dintre hidroxizii a căror structură chimică este complexă la prima vedere. Câteva exemple de hidroxizi și nomenclaturile corespunzătoare ale acestora sunt următoarele: -NaOH (hidroxid de sodiu) -Ca (OH) 2 (hidroxid de calciu) -Fe (OH)3. (Hidroxid feric; hidroxid de fier (III); sau trihidroxid de fier) -V (OH)5 (Hidroxid peranadic; Hidroxid de vanadiu (V); sau pentahidroxid de vanadiu). -Sn (OH)4 (Hidroxid stanic; hidroxid de staniu (IV); sau tetrahidroxid de staniu). -Ba (OH)Două (Hidroxid de bariu sau dihidroxid de bariu). -Mn (OH)6 (Hidroxid de mangan, hidroxid de mangan (VI) sau hexahidroxid de mangan). -AgOH (Hidroxid de argint, hidroxid de argint sau hidroxid de argint). Rețineți că pentru acest compus nu există nicio distincție între stocul și nomenclaturile sistematice. -Pb (OH)4 (Hidroxid de plumb, hidroxid de plumb (IV) sau tetrahidroxid de plumb). -LiOP (hidroxid de litiu). -Cd (OH) 2 (hidroxid de cadmiu) -Ba (OH)Două (Hidroxid de bariu) -Hidroxid de cromAmfotericism
Structuri
Reacție de deshidratare
Nomenclatură
Tradiţional
Stoc
Sistematic
Exemple de hidroxizi


Referințe



Nimeni nu a comentat acest articol încă.