
Caracteristicile, structura, tipurile și funcțiile histonelor
histone sunt proteine de bază care interacționează cu ADN pentru formarea nucleozomilor, care alcătuiesc firele de cromatină care alcătuiesc cromozomii din organismele eucariote.
Nucleozomii, complexe formate din ADN și proteine, au fost descoperite în 1974 și histonele sunt cele care asamblează acest nivel bazal de organizare a cromatinei. Cu toate acestea, existența proteinelor histonice este cunoscută încă din anii 1960..
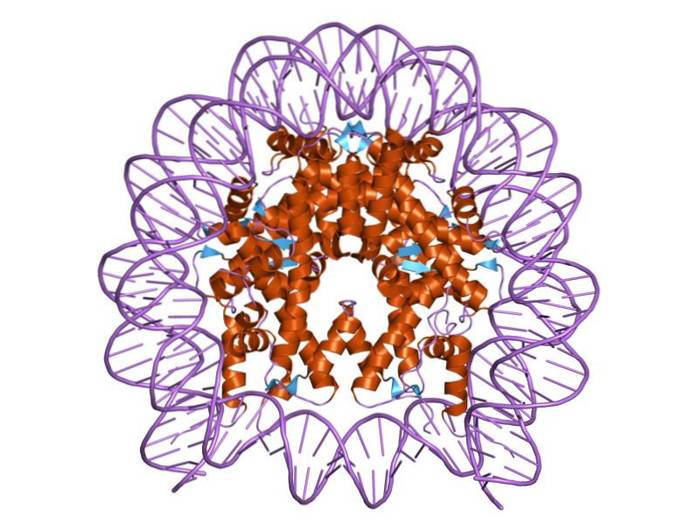
Histonele sunt organizate în așa fel încât ADN-ul cu bandă dublă se înfășoară în jurul unui centru proteic format din aceste proteine care interacționează strâns între ele. Centrul histonei are forma unui disc, iar ADN-ul se învârte de aproximativ 1,7 ori în jurul lui..
Legăturile multiple de hidrogen permit ADN-ului să se lege de centrul proteic format de histonele din fiecare nucleozom. Aceste legături se formează, în cea mai mare parte, între coloana vertebrală a aminoacizilor histonelor și coloana vertebrală zahăr-fosfat a ADN-ului. Participă și unele interacțiuni hidrofobe și legături ionice.
Proteinele cunoscute sub numele de „complexe de remodelare a cromatinei” sunt responsabile pentru descompunerea și formarea legăturilor de joncțiune între ADN și histone, permițând intrarea mașinilor transcripționale în ADN-ul conținut în nucleozomi..
În ciuda apropierii acizilor nucleici de centrul proteic format de histone, aceștia sunt dispuși în așa fel încât, dacă este necesar, să permită intrarea factorilor de transcripție și a altor proteine legate de expresia genică sau de reducerea genei..
Histonele pot suferi diverse modificări care generează mai multe variante, făcând posibilă existența multor forme diferite de cromatină care au proprietatea de a modula expresia genetică în moduri diferite..
Indice articol
- 1 Caracteristici
- 2 Structura
- 2.1 Histone de legare
- 3 tipuri
- 3.1 Histone nucleozomale
- 3.2 Histone de legare
- 4 Funcții
- 5 Referințe
Caracteristici
Sunt una dintre cele mai conservate proteine eucariote din natură. De exemplu, s-a arătat că histona de mazăre H4 diferă în doar două dintre cele 102 poziții de aminoacizi ale proteinei H4 de vacă..
Histonele sunt proteine relativ mici, cu cel mult 140 de aminoacizi. Sunt bogate în reziduuri de aminoacizi bazici, deci au o sarcină netă pozitivă, ceea ce contribuie la interacțiunea lor cu acidul nucleic încărcat negativ pentru a forma nucleozomi..
Sunt cunoscute histonele nucleozomale și de punte. Histonele nucleozomale sunt H3, H4, H2A și H2B, în timp ce histonele de legare aparțin familiei de histone H1.
În timpul asamblării nucleozomilor, inițial se formează dimerii specifici H3-H4 și H2A-H2B. Doi dimeri H3-H4 se unesc apoi pentru a forma tetrameri care ulterior se combină cu dimerii H2A-H2B, formând centrul octameric..
Toate histonele sunt sintetizate în principal în faza S a ciclului celular, iar nucleozomii sunt asamblați în helicile ADN născute, imediat după furca de replicare..
Structura
Structura generală a histonelor include o regiune de aminoacizi bazică și o regiune carboxilică globulară foarte conservată în rândul organismelor eucariote..
Un motiv structural cunoscut sub denumirea de „pli histonic”, compus din trei spirale alfa conectate prin două agrafe de păr și care formează un mic centru hidrofob, este responsabil pentru interacțiunile proteină-proteină dintre histonele care alcătuiesc nucleozomul..
Acest pliu de histone este cel care alcătuiește domeniul carboxil globular al acestor proteine nucleozomale în toate eucariotele..
Histonele au, de asemenea, „cozi” mici sau regiuni amino-terminale și alte regiuni carboxil-terminale (accesibile proteazei), cu o lungime de cel mult 40 de aminoacizi. Ambele regiuni sunt bogate în aminoacizi bazici, care pot suferi modificări covalente post-translaționale multiple..
Histone obligatorii
În eucariote există două familii de histone de legare, diferențiate între ele prin structura lor. Unele au o structură tripartită, cu domeniul globular descris mai sus flancat de domenii N-și C-terminale „nestructurate”; în timp ce altele au doar un domeniu C-terminal.
Deși cele mai multe histone sunt conservate, pot apărea variante specifice în timpul embriogenezei sau maturării celulelor specializate în unele organisme. Unele variații structurale au de-a face cu modificări post-traducătoare, cum ar fi următoarele:
-Fosforilarea: se crede că este legat de modificarea gradului de condensare a cromatinei și apare frecvent în reziduurile de serină.
-Acetilare: asociate cu regiuni cromozomiale care sunt active transcripțional. Apare în mod normal pe lanțurile laterale ale reziduurilor de lizină. Atunci când apar pe aceste reziduuri, sarcina lor pozitivă scade, scăzând astfel afinitatea proteinelor pentru ADN..
-Metilare: poate apărea ca mono-, di- sau trimetilare a reziduurilor de lizină care ies din nucleul proteic.
Enzimele specifice sunt responsabile pentru aceste modificări covalente ale histonelor. Aceste enzime includ histone-acetil transferaze (HAT), complexe histone-deacetilaze (HDAC) și histone-metiltransferaze și demetilaze..
Tipuri
Caracterizarea histonelor a fost realizată prin diferite tehnici biochimice, printre care se remarcă cromatografiile bazate pe rășini slabe de schimb de cationi..
Anumiți autori stabilesc o formă de clasificare în care se disting 5 tipuri principale de histone în eucariote: FI, cu proteine de 21 kDa; F2A1 sau FIV, de plus sau minus 11,3 kDa; F2A2 sau FIIbI, 14,5 kDa; F2B sau FIIb2, cu o greutate moleculară de 13,7 kDa și F3 sau FIII, de 15,3 kDa.
Toate aceste tipuri de histone, cu excepția grupului IF, se găsesc în cantități echimolare în celule..
O altă clasificare, cu aceeași valabilitate și poate cea mai utilizată astăzi, propune existența a două tipuri diferite de histone, și anume: cele care fac parte din octamerul nucleozomului și histonele de legare sau de punte, care unesc nucleosomii între Da.
Unele variante pot apărea, de asemenea, între specii și spre deosebire de histonele de bază, variantele sunt sintetizate în timpul interfazei și sunt inserate în cromatina preformată printr-un proces dependent de energia eliberată de hidroliza ATP..
Histone nucleozomale
Centrul unui nucleozom este format dintr-o pereche din fiecare dintre cele patru histone constitutive: H2a, H2b, H3 și H4; pe care sunt înfășurate segmente de ADN de aproximativ 145 de perechi de baze.
Histonele H4 și H2B sunt, în principiu, invariabile. Unele variații sunt evidente, totuși, în histonele H3 și H2A, ale căror proprietăți biofizice și biochimice modifică natura normală a nucleozomului..
O variantă a histonei H2A la om, proteina H2A.Z are o regiune acidă mare și poate promova stabilitatea nucleozomilor în funcție de variantele histonei H3 cu care este asociată..
Aceste histone prezintă o anumită variabilitate între specii, un caz special fiind cel al histonei H2B, pentru care prima treime a moleculei este foarte variabilă..
Histone obligatorii
Histonele de legare sau punte sunt histone de clasă H1. Acestea sunt responsabile pentru unirea dintre nucleozomi și protecția ADN-ului care iese la începutul și la sfârșitul fiecărei particule..
Spre deosebire de histonele nucleozomale, nu toate histonele de tip H1 posedă regiunea globulară a „pliului” histonei. Aceste proteine se leagă de ADN între nucleozomi, facilitând o schimbare a echilibrului cromatinei către o stare mai condensată și mai puțin activă, transcripțional vorbind..
Studiile au legat aceste histone de îmbătrânire, repararea ADN-ului și procesele apoptotice, motiv pentru care se crede că joacă un rol crucial în menținerea integrității genomice.
Caracteristici
Toate reziduurile de aminoacizi ale histonelor participă, într-un fel sau altul, la interacțiunea lor cu ADN-ul, ceea ce explică faptul că sunt atât de conservate printre regatele organismelor eucariote.
Participarea histonelor la ambalarea ADN-ului sub formă de cromatină are o mare relevanță pentru organismele multicelulare complexe în care diferitele linii celulare se pot specializa doar prin schimbarea accesibilității genelor lor la mașina transcripțională..
Regiunile genomice active transcripțional sunt dense în nucleozomi, sugerând că asocierea ADN-ului cu proteinele histonice este crucială pentru reglarea negativă sau pozitivă a transcrierii lor..
De asemenea, pe tot parcursul vieții unei celule, răspunsul la un număr mare de stimuli, atât interni, cât și externi, depinde de mici modificări ale cromatinei, care în mod normal au legătură cu remodelarea și modificarea post-translațională a histonelor găsite în strânsă relație ADN.
Variabilele histonice multiple îndeplinesc funcții diferite în eucariote. Una dintre ele are legătură cu participarea unei variante a histonei H3 la formarea structurilor centromerice responsabile de segregarea cromozomilor în timpul mitozei..
Omologul acestei proteine din alte eucariote s-a dovedit a fi esențial pentru asamblarea kinetocorului proteic de care se leagă microtubulii fusului în timpul mitozei și meiozei..
Referințe
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K. și Walter, P. (2015). Biologia moleculară a celulei (Ed. A 6-a). New York: Garland Science.
- Campos, E. I. și Reinberg, D. (2009). Histone: adnotarea cromatinei. Annu. Pr. Genet., 43, 559-599.
- Harvey, A. C., și Downs, J. A. (2004). Ce funcții oferă histonele linker? Microbiologie moleculară, 53, 771-775.
- Henikoff, S. și Ahmad, K. (2005). Asamblarea histonelor variabile în cromatină. Annu. Rev. Cell. Dev. Biol., douăzeci și unu, 133-153.
- Isenberg, I. (1979). Histone. Annu. Pr. Biochem., 48, 159-191.
- Kornberg, R. D. și Thomas, J. O. (1974). Structura cromatinei: oligomeri ai histonelor. Ştiinţă, 184(4139), 865-868.
- Smith, E., DeLange, R. și Bonner, J. (1970). Chimia și biologia histonelor. Recenzii fiziologice, cincizeci(2), 159-170.



Nimeni nu a comentat acest articol încă.