
Structura hormonilor steroizi, sinteza, mecanismul de acțiune
hormoni steroizi Sunt substanțe produse de glande de secreție internă și care sunt aruncate direct în fluxul circulator, care îi conduce către țesuturile unde își exercită efectele fiziologice. Numele său generic derivă din faptul că are un nucleu de steroizi în structura sa de bază..
Colesterolul este substanța precursoră din care sunt sintetizați toți hormonii steroizi, care sunt grupați în progestageni (de exemplu progesteron), estrogeni (estronă), androgeni (testosteron), glucocorticoizi (cortizol), mineralocorticoizi (aldosteron) și vitamina D.
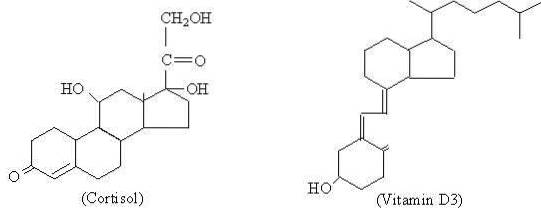
Deși diferiții hormoni steroizi prezintă diferențe moleculare între ei, care le conferă proprietățile lor funcționale diferite, se poate spune că au o structură de bază care le este comună și care este reprezentată de ciclopentaneperhidrofenantrenul a 17 atomi de carbon.
Indice articol
- 1 Structura steroizilor
- 1.1 C21
- 1.2 C19
- 1,3 C18
- 2 Sinteza
- 2.1 - Sinteza la nivelul cortexului suprarenal
- 2.2 - Sinteza androgenilor
- 2.3 - Sinteza steroizilor sexuali masculini în testicule
- 2.4 - Sinteza steroizilor sexuali feminini în ovare
- 3 Mecanismul de acțiune
- 4 Aldosteronul ca exemplu
- 5 Referințe
Structura steroizilor
Steroizii sunt compuși organici de o natură foarte diversă care au în comun ceea ce ar putea fi considerat un nucleu părinte constând din fuziunea a trei inele de șase atomi de carbon (ciclohexan) și unul dintre cei cinci atomi de carbon (ciclopentan).
Această structură este, de asemenea, cunoscută sub numele de "ciclopentaneperhidrofenantren". Deoarece inelele sunt legate reciproc, numărul total de atomi de carbon care îl compun este de 17; Cu toate acestea, majoritatea steroizilor naturali au grupări metil la carbonii 13 și 10, care reprezintă carbonii 18 și respectiv 19..

Mulți dintre compușii steroizi naturali au, de asemenea, unul sau mai multe grupuri cu funcție alcoolică în structura inelului și, prin urmare, sunt numiți steroli. Printre acestea se numără colesterolul, care are o funcție alcoolică la carbonul 3 și un lanț lateral hidrocarbonat de 8 atomi de carbon atașați la carbonul 17; atomii numerotați de la 20 la 27.
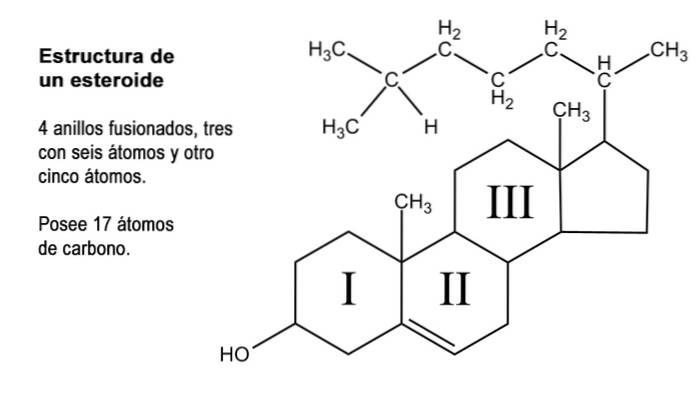
Pe lângă acești 17 carboni, hormonii steroizi pot avea încă 1, 2 sau 4 dintre acești atomi în structura lor, pentru care sunt recunoscute trei tipuri de steroizi, și anume: C21, C19 și C18.
C21
C21, cum ar fi progesteronul și corticosteroizii suprarenali (glucocorticoizi și mineralocorticoizi), sunt derivați din „pregnane”. Are 21 de atomi de carbon, deoarece la cei 17 din inelul de bază se adaugă cele două grupări metilice ale carbonilor 13 și 10 și doi carboni ai lanțului lateral atașat la C17 care inițial, în colesterol, era de 8 atomi de carbon.
C19
C19-urile corespund hormonilor sexuali cu activitate androgenă și sunt derivate din „androstan” (19 atomi de carbon), care este structura care rămâne atunci când pregnanul pierde cei doi carboni ai lanțului lateral C17, care este înlocuit cu un grup hidroxil sau cetonic.
C18
Steroizii C18 sunt hormoni sau estrogeni feminini care sunt sintetizați în principal în gonadele feminine și a căror caracteristică remarcabilă, față de celelalte două tipuri de steroizi, este absența metilului prezent în acesta din urmă atașat carbonului în poziția 10.
În timpul sintezei din colesterol, se produc modificări enzimatice care modifică numărul de atomi de carbon și favorizează dehidrogenările și hidroxilările de atomi de carbon specifici ai structurii..
Sinteză
Celulele care produc hormoni steroizi sunt localizate în principal în cortexul glandelor suprarenale, unde se produc glucocorticoizi precum cortizolul, mineralocorticoizii precum aldosteronul și hormoni sexuali masculini precum dehidroepiandrosteronul și androstendiona..
Gonadele sexuale masculine sunt responsabile pentru producerea de androgeni, inclusiv a hormonilor menționați anterior și a testosteronului, în timp ce foliculii ovarieni care se maturizează produc progesteron și estrogeni..
Sinteza tuturor hormonilor steroizi începe de la colesterol. Această moleculă poate fi sintetizată de celule care produc hormoni steroizi, dar în cea mai mare parte este obținută de aceste celule din lipoproteine cu densitate mică (LDL) prezente în plasma circulantă..
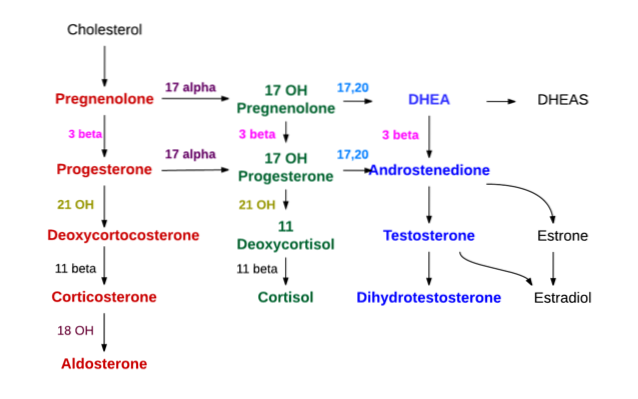
- Sinteza la nivelul cortexului suprarenal
Trei straturi se disting în cortexul suprarenal, cunoscute din exterior ca zone glomerulare, fasciculare și respectiv reticulare..
În glomerular, mineralocorticoizii (aldosteronul) sunt sintetizați în principal, în glucocorticoizii fasciculari precum corticosteronul și cortizolul și în androgenii reticulari precum dehidroepiandrosteronul și androstendiona.
Sinteza glucocorticoizilor
Primul pas în sinteză are loc în mitocondrie și constă în acțiunea unei enzime numite colesterol desmolază, aparținând superfamiliei citocromului P450 și cunoscută și sub denumirea de „P450scc” sau „CYP11A1”, care promovează eliminarea a 6 atomi de carbon a lanțului lateral atașat la C17.
Cu acțiunea desmolazei, colesterolul (din 27 de atomi de carbon) este transformat în pregnenolonă, care este un compus cu 21 de atomi de carbon și reprezintă primul dintre steroizii de tip C21.
Pregnenolonul se deplasează către reticulul endoplasmatic neted, unde prin acțiunea enzimei 3β-hidroxisteroid dehidrogenază suferă deshidrogenare în hidroxilul grupului alcoolic al carbonului 3 și devine progesteron.
Datorită acțiunii 21β-hidroxilazei, numită și „P450C21” sau „CYP21A2”, progesteronul este hidroxilat la carbonul 21 și se transformă în 11-deoxicorticosteron, care revine în mitocondrie și la care se află enzima 11β-hidroxilază („P450C11 ”Sau„ CYP11B1 ”) se transformă în corticosteron.
O altă linie de sinteză în zona fasciculară care se termină nu în corticosteron, ci în cortizol, apare atunci când pregnenolonul sau progesteronul sunt hidroxilați în poziția 17 de 17α-hidroxilază ("P450C17" sau "CYP17") și au transformat 17-hidroxipregnolonă sau 17-hidroxiprogesteronă.
Aceeași enzimă deja menționată, 3β-hidroxisteroid dehidrogenază, care convertește pregnenolona în progesteron, convertește și 17-hidroxipregnolonă în 17-hidroxiprogesteronă.
Acesta din urmă este transportat succesiv, de către ultimele două enzime ale căii care produce corticosteron (21β-hidroxilază și 11β-hidroxilază) la deoxicortizol și, respectiv, cortizol..
Acțiuni glucocorticoide
Principalii glucocorticoizi produși în zona fasciculară a cortexului suprarenal sunt corticosteronul și cortizolul. Ambele substanțe, dar în special cortizolul, prezintă un spectru larg de acțiuni care afectează metabolismul, sângele, apărarea și răspunsurile de vindecare a rănilor, mineralizarea osoasă, tractul digestiv, sistemul circulator și plămânii..
În ceea ce privește metabolismul, cortizolul stimulează lipoliza și eliberarea acizilor grași care pot fi utilizați în ficat pentru formarea corpurilor cetonice și a proteinelor cu densitate mică (LDL); scade absorbția și lipogeneza glucozei în țesutul adipos și absorbția și utilizarea glucozei în mușchi.
De asemenea, promovează catabolismul proteinelor în periferie: în țesutul conjunctiv, matricea musculară și osoasă, eliberând astfel aminoacizi care pot fi utilizați în ficat pentru sinteza proteinelor plasmatice și pentru gluconeogeneză. În plus, stimulează absorbția glucozei intestinale prin creșterea producției de transportori SGLT1..
Absorbția accelerată a glucozei intestinale, creșterea producției hepatice și utilizarea scăzută a acestui carbohidrat în mușchi și țesutul adipos favorizează o creștere a nivelului de glucoză plasmatică..
În ceea ce privește sângele, cortizolul favorizează procesul de coagulare, stimulează formarea granulocitelor neutrofile și inhibă cel al eozinofilelor, bazofilelor, monocitelor și limfocitelor T. De asemenea, inhibă eliberarea mediatorilor inflamatori precum prostaglandinele, interleukinele, limfokinele, histamina și serotonina.
În termeni generali, se poate spune că glucocorticoizii interferează cu răspunsul imun, motiv pentru care pot fi utilizați terapeutic în acele cazuri în care acest răspuns este exagerat sau inadecvat, cum ar fi în cazul bolilor autoimune sau în transplanturile de organe pentru a reduce respingere.
- Sinteza androgenilor
Sinteza androgenilor la nivelul cortexului suprarenal are loc în principal la nivelul zonei reticulare și de la 17-hidroxipregnolonă și 17-hidroxiprogesteronă.
Aceeași enzimă 17α-hidroxilază, care produce cele două substanțe tocmai menționate, are, de asemenea, o activitate de 17,20 liasă, care elimină cei doi atomi de carbon ai lanțului lateral C17 și îi înlocuiește cu o grupare ceto (= O).
Această ultimă acțiune reduce numărul de carbon cu două și produce steroizi de tip C19. Dacă acțiunea este asupra 17-hidroxipregnolonului, rezultatul este dehidroepiandrosteron; dacă, dimpotrivă, substanța afectată este hidroxiprogesteronă, atunci produsul va fi androstendionă.
Ambii compuși fac parte din așa-numiții 17-cetosteroizi, deoarece au o grupă cetonică la carbonul 17.
De asemenea, 3β-hidroxisteroid dehidrogenaza convertește dehidroepiandrosteronul în androstendionă, dar cel mai frecvent este că primul este transformat în dehidroepiandrosteron sulfat de o sulfokinază, prezentă aproape exclusiv în zona reticulară.
Sinteza mineralocorticoizilor (aldosteron)
Zona glomerulară nu are enzima 17α-hidroxilază și nu poate sintetiza precursorii 17-hidroxisteroizi ai cortizolului și ai hormonilor sexuali. De asemenea, nu are 11β-hidroxilază, dar are o enzimă numită aldosteron sintetază care poate produce secvențial corticosteron, 18-hidroxicorticosteron și mineralocorticoid aldosteron..
Acțiuni ale mineralocorticoizilor
Cel mai important mineralocorticoid este aldosteronul sintetizat în zona glomerulară a cortexului suprarenal, dar glucocorticoizii prezintă și activitate mineralocorticoidă.
Activitatea mineralocorticoidă a aldosteronului se dezvoltă la nivelul epiteliului tubular al nefronului distal, unde promovează secreția reabsorbției de sodiu (Na +) și a potasiului (K +), contribuind astfel la conservarea nivelurilor acestor ioni în fluidele corpului..
- Sinteza steroizilor sexuali masculini în testicule
Sinteza testiculară a androgenilor are loc la nivelul celulelor Leydig. Testosteronul este principalul hormon androgen produs în testicule. Sinteza sa implică producția inițială de androstendion, așa cum a fost descris anterior pentru sinteza androgenilor la nivelul cortexului suprarenal..
Androstendionul este transformat în testosteron prin acțiunea enzimei 17β-hidroxisteroid dehidrogenază, care înlocuiește grupa cetonă a carbonului 17 cu o grupare hidroxil (OH).
În unele țesuturi care servesc drept țintă pentru testosteron, acesta este redus cu o 5α-reductază la dihidrotestosteron, cu o putere androgenă mai mare.
- Sinteza steroizilor sexuali feminini în ovare
Această sinteză apare ciclic însoțind modificările care apar în timpul ciclului sexual feminin. Sinteza are loc în folicul care în fiecare ciclu se maturizează pentru a elibera un ou și apoi produce corpul galben corespunzător.
Estrogenii sunt sintetizați în celulele granulare ale foliculului matur. Foliculul matur are celule în teca care produc androgeni precum androstendiona și testosteronul..
Acești hormoni se difuzează în celule granuloase vecine, care posedă enzima aromatază care le transformă în estronă (E1) și 17β-estradiol (E2). Din ambele, se sintetizează estriolul.
Acțiuni ale steroizilor sexuali
Androgenii și estrogenii au ca funcție principală dezvoltarea caracteristicilor sexuale masculine și, respectiv, feminine. Androgenii au efecte anabolice favorizând sinteza proteinelor structurale, în timp ce estrogenii favorizează procesul de osificare.
Estrogenii și progesteronul eliberat în timpul ciclului sexual feminin sunt destinate să pregătească corpul femeii pentru o eventuală sarcină ca urmare a fertilizării oului matur eliberat în timpul ovulației..
Mecanism de acțiune
Dacă trebuie să vă reîmprospătați memoria despre mecanismul de acțiune al hormonilor, este recomandat să urmăriți următorul videoclip înainte de a continua citirea.
Mecanismul de acțiune al hormonilor steroizi este destul de similar la toți. În cazul compușilor lipofili, aceștia se dizolvă fără dificultate în membrana lipidică și pătrund în citoplasma celulelor lor țintă, care au receptori citoplasmatici specifici pentru hormonul la care trebuie să răspundă..
Odată ce complexul hormon-receptor este format, acesta traversează membrana nucleară și se leagă în genom, sub forma unui factor de transcripție, cu un element de răspuns hormonal (HRE) sau o genă de răspuns primar, care la rândul său poate regla uneori alte gene numit răspuns secundar.
Rezultatul final este promovarea transcrierii și sinteza ARN-urilor mesager care sunt traduse în ribozomii reticulului endoplasmatic dur care ajung să sintetizeze proteinele induse de hormon..
Aldosteronul ca exemplu
Acțiunea aldosteronului se exercită în principal la nivelul porțiunii finale a tubului distal și în canalele colectoare, unde hormonul promovează reabsorbția Na + și secreția K+.
În membrana luminală a principalelor celule tubulare ale acestei regiuni, există canale epiteliale Na + și canale K + de tip „ROMK”. Canal de potasiu medular extern renal).
Membrana basolaterală are pompe Na + / K + ATPază care atrag continuu Na + din celulă în spațiul interstițial basolateral și introduc K + în celulă. Această activitate menține concentrația intracelulară de Na + foarte scăzută și favorizează crearea unui gradient de concentrație pentru acest ion între lumenul tubului și celulă..
Acest gradient permite Na + să se deplaseze spre celulă prin canalul epitelial și, din moment ce Na + trece singur, pentru fiecare ion care se mișcă rămâne o sarcină negativă necompensată care determină lumenul tubului să devină negativ față de interstițiu. Adică, cu lumina negativă se creează o diferență de potențial transepitelial.
Această negativitate a luminii favorizează ieșirea K + care se mișcă prin concentrația sa mai mare în celulă și negativitatea luminii este secretată spre lumenul tubului pentru a fi în cele din urmă excretată. Această activitate de reabsorbție a Na + și secreția K + este reglată de acțiunea aldosteronului..
Aldosteronul prezent în sânge și eliberat din zona glomerulară ca răspuns la acțiunea angiotensinei II sau la hiperkaliemie, pătrunde în celulele principale și se leagă cu receptorul său intracitoplasmatic.
Acest complex ajunge la nucleu și promovează transcrierea genelor a căror expresie va ajunge să crească sinteza și activitatea pompelor Na + / K +, canalelor epiteliale Na + și canalelor ROMK K +, precum și ale altor proteine. Răspuns care va avea efectul general al retenției de Na + în organism și creșterea excreției urinare de K+.
Referințe
- Ganong WF: Medulla suprarenală și cortexul suprarenal, ediția a 25-a. New York, McGraw-Hill Education, 2016.
- Guyton AC, Sala JE: Hormoni adrenocorticali, în Manual de fiziologie medicală , Ediția a 13-a, AC Guyton, JE Hall (ed.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Verrey F: Hormon, în Physiologie des Menschen mit Pathophysiologie, Ed. 31, RF Schmidt și colab. (Eds). Heidelberg, Springer Medizin Verlag, 2010.
- Voigt K: Endokrines System, În: Physiologie, ediția a 6-a; R Klinke și colab. (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H și Strang KT: Fiziologia reproducerii feminine, în Vander's Human Physiology: The Mechanisms of Body Function, ediția a XIII-a; EP Widmaier și colab. (Eds). New York, McGraw-Hill, 2014.



Nimeni nu a comentat acest articol încă.