
Aplicații ale legii Beer-Lambert și exerciții rezolvate
Legea Beer-Lambert (Beer-Bouguer) este unul care raportează absorbția radiației electromagnetice a uneia sau mai multor specii chimice, cu concentrația sa și distanța pe care o parcurge lumina în interacțiunile particule-fotoni. Această lege reunește două legi într-una.
Legea lui Bouguer (deși recunoașterea a căzut mai mult asupra lui Heinrich Lambert), stabilește că o probă va absorbi mai multă radiație atunci când dimensiunile mediului absorbant sau ale materialului sunt mai mari; în mod specific, grosimea sa, care este distanța l că lumina călătorește când intră și iese.
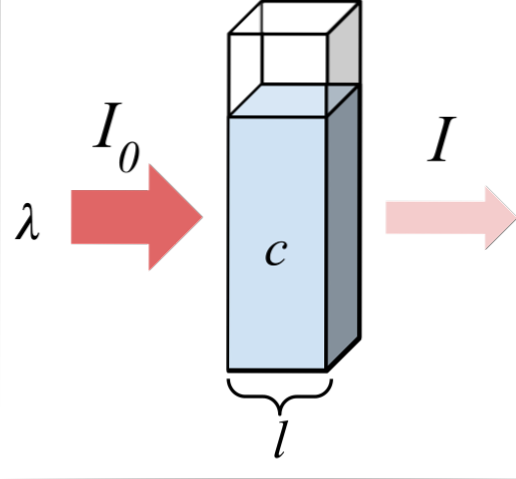
Imaginea superioară arată absorbția radiației monocromatice; adică alcătuită dintr-o singură lungime de undă, λ. Mediul absorbant se află în interiorul unei celule optice, a cărei grosime este l, și conține specii chimice cu o concentrație c.
Fasciculul de lumină are o intensitate inițială și finală, desemnată prin simbolurile I0 și respectiv eu. Rețineți că, după interacțiunea cu mediul absorbant, I este mai mic decât mine0, ceea ce arată că a existat absorbția radiațiilor. Cu cât sunt mai în vârstă c Da l, mai mic va fi eu față de I0; adică va fi mai multă absorbție și mai puțină transmitanță.
Indice articol
- 1 Ce este legea Beer-Lambert?
- 1.1 Absorbanță și transmitanță
- 1.2 Grafică
- 2 Aplicații
- 3 exerciții rezolvate
- 3.1 Exercițiul 1
- 3.2 Exercițiul 2
- 4 Referințe
Ce este legea Beer-Lambert?
Imaginea de mai sus cuprinde perfect această lege. Absorbția radiațiilor dintr-o probă crește sau scade exponențial în funcție de c sau l. Pentru a înțelege pe deplin și cu ușurință legea, este necesar să se înconjoare aspectele sale matematice.
După cum am menționat, eu0 și I sunt intensitățile fasciculului de lumină monocromatică înainte și după lumină, respectiv. Unele texte preferă să folosească simbolurile P0 și P, care se referă la energia radiației și nu la intensitatea acesteia. Aici, explicația va fi continuată folosind intensitățile.
Pentru a lineari ecuația acestei legi, trebuie aplicat logaritmul, în general baza 10:
Jurnal (I0/ I) = εlc
Termenul (I0/ I) indică cât scade intensitatea produsului de radiație de absorbție. Legea lui Lambert consideră doar l (εl), în timp ce legea lui Beer ignoră l, dar locurile c în schimb (εc). Ecuația superioară este uniunea ambelor legi și, prin urmare, este expresia matematică generală pentru legea Beer-Lambert.
Absorbanță și transmitanță
Absorbanta este definita de termenul Log (I0/ I). Astfel, ecuația este exprimată după cum urmează:
A = εlc
Unde ε este coeficientul de extincție sau absorbția molară, care este o constantă la o lungime de undă dată.
Rețineți că, dacă grosimea mediului absorbant este menținută constantă, ca ε, absorbanța A va depinde doar de concentrație c, de specii absorbante. De asemenea, este o ecuație liniară, y = mx, unde Da este A și X este c.
Pe măsură ce absorbanța crește, transmitanța scade; adică câtă radiație reușește să fie transmisă după absorbție. Prin urmare, ele sunt inverse. da eu0/ I indică gradul de absorbție, I / I0 este egal cu transmitanța. Știind acest lucru:
Eu / eu0 = T
(Eu0/ I) = 1 / T
Jurnal (I0/ I) = Jurnal (1 / T)
Dar, Log (I0/ I) este, de asemenea, egal cu absorbanta. Deci relația dintre A și T este:
A = Jurnal (1 / T)
Și aplicând proprietățile logaritmilor și știind că Log1 este egal cu 0:
A = -LogT
Transmitențele sunt de obicei exprimate în procente:
% T = I / I0∙ 100
Diagramele
După cum sa menționat anterior, ecuațiile corespund unei funcții liniare; prin urmare, este de așteptat ca atunci când le graficizăm să dea o linie.
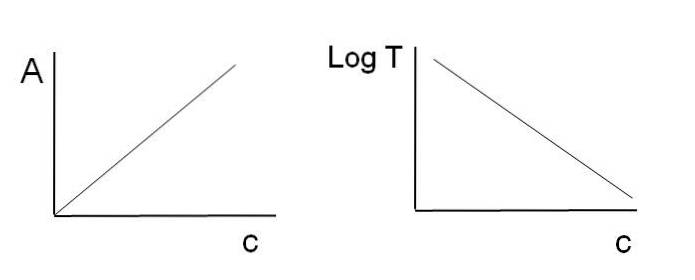
Rețineți că în stânga imaginii de mai sus există linia obținută prin graficul A împotriva c, iar în dreapta linia corespunzătoare graficului LogT împotriva c. Una are o pantă pozitivă, iar cealaltă negativă; cu cât absorbanța este mai mare, cu atât transmitanța este mai mică.
Datorită acestei linearități, concentrația speciei chimice absorbante (cromofori) poate fi determinată dacă se știe câtă radiație absorb (A) sau câtă radiație este transmisă (LogT). Când această liniaritate nu este respectată, se spune că se confruntă cu o abatere, pozitivă sau negativă, a legii Beer-Lambert.
Aplicații
În termeni generali, unele dintre cele mai importante aplicații ale acestei legi sunt menționate mai jos:
-Dacă o specie chimică prezintă culoare, este un candidat exemplar care trebuie analizat prin tehnici colorimetrice. Acestea se bazează pe legea Beer-Lambert și permit determinarea concentrației analiților în funcție de absorbanțele obținute cu un spectrofotometru..
-Permite construirea curbelor de calibrare, cu care, luând în considerare efectul matricial al probei, se determină concentrația speciilor de interes.
-Este utilizat pe scară largă pentru a analiza proteinele, deoarece mai mulți aminoacizi au absorbții semnificative în regiunea ultravioletă a spectrului electromagnetic..
-Reacțiile chimice sau fenomenele moleculare care implică o schimbare de culoare pot fi analizate folosind valori de absorbanță la una sau mai multe lungimi de undă..
-Folosind analiza multivariată, pot fi analizate amestecuri complexe de cromofori. În acest fel, se poate determina concentrația tuturor analiților și, de asemenea, amestecurile pot fi clasificate și diferențiate între ele; de exemplu, excludeți dacă două minerale identice provin din același continent sau țară specifică.
Exerciții rezolvate
Exercitiul 1
Care este absorbanța unei soluții care prezintă o transmisie de 30% la o lungime de undă de 640 nm??
Pentru a o rezolva, mergeți la definițiile absorbantei și transmitanței.
% T = 30
T = (30/100) = 0,3
Și știind că A = -LogT, calculul este simplu:
A = -Log 0.3 = 0.5228
Rețineți că îi lipsesc unitățile.
Exercițiul 2
Dacă soluția din exercițiul anterior constă dintr-o specie W a cărei concentrație este de 2,30 ∙ 10-4 M, și presupunând că celula are o grosime de 2 cm: care ar trebui să fie concentrația sa pentru a obține o transmisie de 8%??
S-ar putea rezolva direct cu această ecuație:
-LogT = εlc
Dar, valoarea lui ε este necunoscută. Prin urmare, trebuie calculat cu datele anterioare și se presupune că rămâne constant pe o gamă largă de concentrații:
ε = -LogT / lc
= (-Log 0.3) / (2 cm x 2.3 ∙ 10-4 M)
= 1136,52 M-1∙ cm-1
Și acum, puteți continua calculul cu% T = 8:
c = -LogT / εl
= (-Log 0,08) / (1136,52 M-1∙ cm-1 x 2cm)
= 4,82 ∙ 10-4 M
Apoi, este suficient ca speciile W să-și dubleze concentrația (4,82 / 2,3) pentru a-și reduce procentul de transmisie de la 30% la 8%..
Referințe
- Day, R. și Underwood, A. (1965). Chimie analitică cantitativă. (ediția a cincea). PEARSON Prentice Hall, p 469-474.
- Skoog D.A., West D.M. (1986). Analiza instrumentală. (a doua ed.). Interamericana., Mexic.
- Soderberg T. (18 august 2014). Legea Beer-Lambert. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- Clark J. (mai 2016). Legea Beer-Lambert. Recuperat de pe: chemguide.co.uk
- Analiză colorimetrică: legea berii sau analiză spectrofotometrică. Recuperat de la: chem.ucla.edu
- Dr. J.M. Fernandez Alvarez. (s.f.). Chimie analitică: manual de probleme rezolvate. [PDF]. Recuperat de la: dadun.unav.edu



Nimeni nu a comentat acest articol încă.