
Masa molară cum se calculează, exemple și exerciții rezolvate
Masă molară este o proprietate intensivă a materiei care leagă conceptul de aluniță cu măsurătorile de masă. Fiind mai concis, este cantitatea de masă corespunzătoare unui mol de substanță; adică ce „cântărește” un număr Avogadro, (6.022 · 102. 3) de particule determinate.
Un mol din orice substanță va conține același număr de particule (ioni, molecule, atomi etc.); cu toate acestea, masa sa va varia, deoarece dimensiunile sale moleculare sunt definite de numărul de atomi și izotopii care alcătuiesc structura sa. Cu cât atomul sau molecula este mai masivă, cu atât este mai mare masa sa molară..
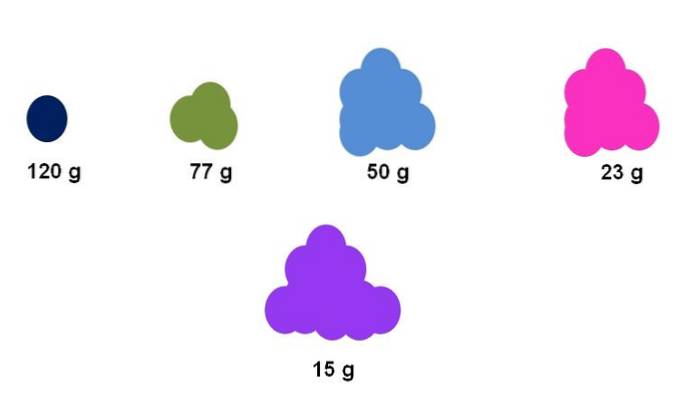
De exemplu, să presupunem că se colectează exact un mol pentru cinci compuși diferiți (imaginea de sus). Folosind o balanță, a fost măsurată masa pentru fiecare grup, exprimată mai jos. Această masă corespunde masei molare. Dintre toate, compusul purpuriu are cele mai ușoare particule, în timp ce compusul albastru închis are cele mai grele particule..
Rețineți că este prezentată o tendință generalizată și exagerată: cu cât masa molară este mai mare, cu atât este mai mică cantitatea de eșantion care trebuie plasată pe balanță. Cu toate acestea, acest volum de materie este, de asemenea, foarte dependent de starea de agregare a fiecărui compus și de densitatea acestuia..
Indice articol
- 1 Cum calculați masa molară?
- 1.1 Definiție
- 1.2 Elemente
- 1.3 Compuși
- 2 Exemple
- 3 exerciții rezolvate
- 3.1 Exercițiul 1
- 3.2 Exercițiul 2
- 3.3 Exercițiul 3
- 4 Referințe
Cum calculați masa molară?

Definiție
Masa molară poate fi calculată pe baza definiției sale: cantitatea de masă per mol de substanță:
M = grame de substanță / mol de substanță
De fapt, g / mol este unitatea în care masa molară este de obicei exprimată, împreună cu kg / mol. Astfel, dacă știm câți moli avem dintr-un compus sau element și îl cântărim, vom ajunge direct la masa sa molară aplicând o diviziune simplă.
Elemente
Masa molară nu se aplică numai compușilor, ci și elementelor. Conceptul de alunițe nu discriminează deloc. Prin urmare, cu ajutorul unui tabel periodic localizăm masele atomice relative pentru un element de interes și înmulțim valoarea acestuia cu 1 g / mol; aceasta este constanta lui Avogadro, MSAU.
De exemplu, masa atomică relativă a stronțiului este 87,62. Dacă vrem să avem masa sa atomică, ar fi 87,62 amu; dar dacă ceea ce căutăm este masa sa molară, atunci va fi de 87,62 g / mol (87,62 · 1g / mol). Și astfel, masele molare ale tuturor celorlalte elemente sunt obținute în același mod, fără a fi nevoie chiar să efectueze multiplicarea menționată..
Compuși
Masa molară a unui compus nu este altceva decât suma maselor atomice relative ale atomilor săi înmulțită cu MSAU.
De exemplu, molecula de apă, HDouăSau are trei atomi: doi hidrogen și un oxigen. Masele atomice relative ale lui H și O sunt, respectiv, 1,008 și 15,999. Astfel, le adăugăm masele înmulțind cu numărul de atomi prezenți în molecula compusului:
2 H (1,008) = 2,016
1 O (15.999) = 15.999
M(HDouăO) = (2.016 + 15.999) 1g / mol = 18.015 g / mol
Este o practică destul de obișnuită de omis MSAU în cele din urmă:
M(HDouăO) = (2.016 + 15.999) = 18.015 g / mol
Se înțelege că masa molară are unități de g / mol.
Exemple
Tocmai a fost menționată una dintre cele mai cunoscute mase molare: cea a apei, 18 g / mol. Cei care sunt familiarizați cu aceste calcule ajung la un punct în care sunt capabili să memoreze unele mase molare fără a fi nevoie să le caute sau să le calculeze așa cum s-a făcut mai sus. Unele dintre aceste mase molare, care servesc drept exemple, sunt următoarele:
-SAUDouă: 32 g / mol
-NDouă: 28 g / mol
-NH3: 17 g / mol
-CH4: 16 g / mol
-CODouă: 44 g / mol
-HCI: 36,5 g / mol
-HDouăSW4: 98 g / mol
-CH3COOH: 60 g / mol
-Fe: 56 g / mol
Rețineți că valorile date sunt rotunjite. Pentru scopuri mai precise, masele molare ar trebui exprimate cu zecimale mai mari și calculate cu masele atomice relative datorate și exacte.
Exerciții rezolvate
Exercitiul 1
Prin metode analitice, s-a estimat că o soluție a unei probe conține 0,0267 moli de analit D. De asemenea, se știe că masa acesteia corespunde cu 14% dintr-o probă a cărei masă totală este de 76 grame. Calculați masa molară a analitului supus D.
Trebuie să determinăm masa de D care este dizolvată în soluție. Continuăm:
Masa (D) = 76 g 0,14 = 10,64 g D
Adică, calculăm 14% din cele 76 de grame ale eșantionului, care corespund gramelor de analit D. Apoi, și în cele din urmă, aplicăm definiția masei molare, deoarece avem suficiente date pentru a o calcula:
M(D) = 10,64 g D / 0,0267 mol D
= 398,50 g / mol
Ceea ce se traduce prin: o aluniță (6.022102. 3) a moleculelor Y are o masă egală cu 398,50 grame. Datorită acestei valori putem ști cât de mult din Y vrem să cântărim pe balanță în cazul în care dorim, de exemplu, să pregătim o soluție cu o concentrație molară de 5 · 10-3 M; adică se dizolvă 0,1993 grame de Y într-un litru de solvent:
5 10-3 (mol / L) · (398,50 g / mol) = 0,1993 g Y
Exercițiul 2
Calculați masa molară a acidului citric știind că formula sa moleculară este C6H8SAU7.
Aceeași formulă C6H8SAU7 Facilitează înțelegerea calculului, deoarece ne indică imediat numărul de atomi de C, H și O care se află în acid citric. Prin urmare, repetăm același pas efectuat pentru apă:
6 C · (12.0107) = 72.0642
8 H (1.008) = 8.064
7 O (15.999) = 111.993
M(acid citric) = 72.0642 + 8.064 + 111.993
= 192,1212 g / mol
Exercițiul 3
Calculați masa molară a sulfatului de cupru pentahidrat, CuSO45HDouăSAU.
Știm dinainte că masa molară a apei este de 18,015 g / mol. Acest lucru ne ajută să simplificăm calculele, întrucât îl omitem pentru moment și ne concentrăm asupra sării anhidre CuSO4.
Avem că masele atomice relative ale cuprului și sulfului sunt 63,546 și respectiv 32,065. Cu aceste date, procedăm la fel ca în exercițiul 2:
1 Cu (63.546) = 63.546
1 S (32.065) = 32.065
4 O (15.999) = 63.996
M(CuSO4) = 63.546 + 32.065 + 63.996
= 159.607 g / mol
Dar ne interesează masa molară a sării pentahidratate, nu cea anhidră. Pentru a face acest lucru, trebuie să adăugăm masa corespunzătoare de apă la rezultat:
5 oreDouăO = 5 (18.015) = 90.075
M(CuSO45HDouăO) = 159.607 + 90.075
= 249,682 g / mol
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Wikipedia. (2020). Masă molară. Recuperat de pe: en.wikipedia.org
- Nissa Garcia. (2020). Ce este masa molară? Definiție, formulă și exemple. Studiu. Recuperat de la: study.com
- Dr. Kristy M. Bailey. (s.f.). Tutorial de stoichiometrie
Găsirea masei molare. Recuperat de pe: occc.edu - Helmenstine, Anne Marie, dr. (02 decembrie 2019). Exemplu de masă molară. Recuperat de pe: thoughtco.com



Nimeni nu a comentat acest articol încă.