
Potențiometru (pH-metru) Pentru ce este și cum funcționează

A potențiometru este dispozitivul utilizat pentru a măsura diferența de potențial între un electrod de lucru și un electrod de referință, atunci când ambii sunt scufundați într-o soluție a cărei dorință este de a determina aciditatea sau basicitatea acestuia, exprimând acest lucru ca pH.
În acest fel, potențiometria se referă la metoda analitică utilizată pentru a determina concentrația ionilor H.+ într-o substanță care este în soluție, prin utilizarea unui potențiometru și a celor doi electrozi menționați anterior.

În cazul electrodului de referință, acesta are un potențial cunoscut, constant și stabil, spre deosebire de electrodul de lucru. Potențialul care se dezvoltă în acest ultim electrod variază proporțional cu concentrația ionilor H+ care sunt în soluție.
Acest potențial este, de asemenea, foarte influențat de temperatura la care se efectuează măsurarea..
Indice articol
- 1 Pentru ce este?
- 2 Cum funcționează?
- 2.1 Electrozi
- 2.2 Calibrarea unui potențiometru
- 3 Referințe
Pentru ce este?
Există un număr mare de procese care se desfășoară în domeniul industrial - cum ar fi producția de medicamente, procesarea alimentelor și purificarea apei - care sunt extrem de sensibile la variațiile nivelurilor de pH. Din acest motiv, măsurarea corectă a acestuia este atât de importantă.
După cum s-a menționat anterior, pH-ul este un parametru utilizat pentru a măsura aciditatea sau alcalinitatea unei soluții care se află în faza apoasă prin analiza concentrației de ioni H.+ în soluție. Apoi, valoarea pH-ului este calculată prin următoarea ecuație:
pH = -log [H+]
Deci, potențiometrul este utilizat pentru a măsura pH-ul unei substanțe în soluție..
Când potențiometrul este conectat la cei doi electrozi cufundați în soluția de analizat, acesta detectează diferența de potențial dintre electrodul de lucru și electrodul de referință, amplificând acest semnal și transformându-l într-o valoare pH folosind ecuația descrisă mai sus..
Cum functioneazã?
Funcționarea unui potențiometru se bazează pe mecanismul unei celule electrochimice, unde sunt implicați ioni H+ în reacția chimică a celulei pentru a determina concentrația acestor ioni în soluție și, în acest fel, pentru a obține pH-ul aceluiași.
Când se dorește măsurarea pH-ului unei soluții prin potențiometrie, se utilizează un potențiometru și un electrod; primul este dispozitivul care determină pH-ul, în timp ce al doilea se bazează pe combinația dintre un electrod de referință și un electrod de măsurare sensibil la analiți.
În acest sens, se formează un circuit prin care curentul electric curge între electrozi și soluție, unde aceștia îndeplinesc funcția de baterie atunci când sunt scufundați în soluția menționată..
În acest fel, potențiometrul este proiectat pentru a genera o tensiune egală cu zero (în unități de milivolți) atunci când are un pH egal cu șapte; adică neutru.
La fel, atunci când se înregistrează o creștere a valorilor potențiale (cu numere pozitive) înseamnă că există valori mai mici ale pH-ului și când se observă o scădere-adică o creștere către numere negative- vorbim de valori mai mari..
Electrozi
Electrodul de măsurare (sau de lucru) constă dintr-un dispozitiv în care are loc reacția studiată (oxidare sau reducere).
Deși există multe tipuri, este în general sticlă, constând dintr-o membrană de sticlă foarte subțire care are permeabilitate la ionii H.+ a mediului în care se află.
Prin plasarea acestuia într-o soluție care are un pH diferit de cel al soluției prezente în celulă, se generează o diferență de potențial între cele două fețe ale membranei și această diferență poate fi înregistrată prin intermediul unui electrod de referință..
Pe de altă parte, electrodul de referință este un dispozitiv care are caracteristici de potențial stabil și cu o valoare cunoscută, care este utilizat în mod normal ca anod în celula electrochimică..
Un exemplu al acestui tip de electrod este unul care este alcătuit dintr-un fir de argint, care este acoperit cu clorură de argint și scufundat într-o soluție diluată de acid clorhidric sau electrodul de referință saturat cu calomel, ca cel prezentat în figura de mai jos..
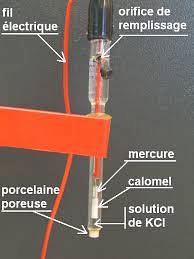
Deci potențiometrul determină diferența de potențial generată între electrozi, deși numai potențialul electrodului de lucru depinde de concentrațiile speciei ionice..
Calibrarea unui potențiometru
Calibrarea unui potențiometru trebuie efectuată prin soluții tampon cunoscute (numite și tampoane sau soluții tampon), care constau din sisteme cu pH practic invariabil care conțin o substanță slabă și speciile sale conjugate..
Fiecare tampon are un pH specific, care poate fi acid (pH<7), básico (pH>7) sau neutru (pH = 7) și poate fi achiziționat comercial deja standardizat sau preparat în laborator cu reactivi certificați și folosind proceduri stabilite și validate..
Deoarece potențiometrele măsoară valoarea pH-ului într-un interval considerat larg, trebuie să se știe dacă analitul are un pH mai mare sau mai mic de șapte pentru a continua calibrarea corectă..
Astfel, pentru probele al căror pH este de așteptat să fie de bază, acesta ar trebui să fie calibrat cu o soluție tampon cu un pH egal cu șapte și o altă cu un pH mai mare (în mod normal se folosește unul cu pH zece)..
Pe de altă parte, pentru probele cu un pH acid preconizat, acesta este calibrat cu o soluție tampon cu un pH egal cu șapte și o altă cu un pH mai mic (în mod normal se folosește un pH patru)..
În cele din urmă, recalibrarea acestui instrument de măsurare trebuie efectuată înainte și după fiecare utilizare, înregistrând rezultatele acestuia, inclusiv data și ora la care au fost efectuate și caracteristicile soluțiilor tampon utilizate pentru controlul acestuia..
Referințe
- Wikipedia. (s.f.). contor de pH. Obținut de la es.wikipedia.org
- Chang, R. (2007). Chimie, ediția a IX-a. (McGraw-Hill).
- Westcott, C. (2012). Măsurătorile Ph. Obținut din books.google.co.ve
- Nielsen, C. (1996). Gestionarea laboratorului analitic: simplu și simplu. Obținut din books.google.co.ve
- Kenkel, J. (2010). Chimie analitică pentru tehnicieni, ediția a treia. Obținut din books.google.co.ve
- Cable, M. (2005). Calibrare: un ghid al tehnicianului. Obținut din books.google.co.ve

Nimeni nu a comentat acest articol încă.