
Spectru de absorbție absorbție atomică, vizibilă și moleculară
A Spectru de absorbție Este produsul interacțiunii luminii cu un material sau substanță în oricare dintre stările sale fizice. Dar definiția depășește o simplă lumină vizibilă, deoarece interacțiunea include un segment larg al gamei de lungimi de undă și energie a radiației electromagnetice..
Prin urmare, unele solide, lichide sau gaze pot absorbi fotoni de diferite energii sau lungimi de undă; de la radiații ultraviolete, urmate de lumină vizibilă, la radiații sau lumină infraroșie, pășind în lungimile de undă ale microundelor.

Ochiul uman percepe doar interacțiunile materiei cu lumina vizibilă. De asemenea, poate contempla difracția luminii albe printr-o prismă sau un mediu în componentele sale colorate (imaginea superioară).
Dacă raza de lumină ar fi „prinsă” după ce a călătorit printr-un material și a fost analizată, s-ar găsi absența anumitor benzi de culori; adică s-ar observa dungi negre care contrastează cu fundalul său. Acesta este spectrul de absorbție, iar analiza sa este fundamentală în chimia analitică instrumentală și astronomie..
Indice articol
- 1 Absorbția atomică
- 1.1 Tranziții și energii electronice
- 2 Spectru vizibil
- 3 Spectrul de absorbție al moleculelor
- 3.1 Albastru de metilen
- 3.2 Clorofilele a și b
- 4 Referințe
Absorbția atomică
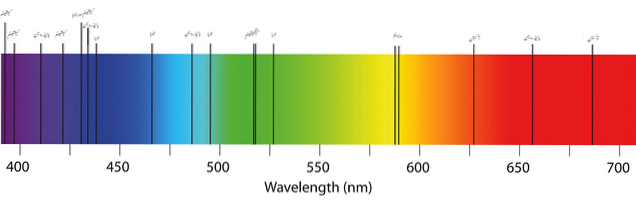
Imaginea superioară arată un spectru tipic de absorbție al elementelor sau atomilor. Rețineți că benzile negre reprezintă lungimile de undă absorbite, în timp ce celelalte sunt cele emise. Aceasta înseamnă că, în contrast, un spectru de emisii atomice ar arăta ca o bandă neagră cu dungi de culori emise..
Dar ce sunt aceste dungi? Cum să știm pe scurt dacă atomii absorb sau emit (fără a introduce fluorescență sau fosforescență)? Răspunsurile stau în stările electronice permise ale atomilor.
Tranziții și energii electronice
Electronii sunt capabili să se îndepărteze de nucleu lăsându-l încărcat pozitiv în timp ce tranzitează de la un orbital cu energie inferioară la unul cu energie mai mare. Pentru aceasta, explicată de fizica cuantică, absorb fotonii unei anumite energii pentru a realiza tranziția electronică menționată..
Prin urmare, energia este cuantificată și nu vor absorbi jumătate sau trei sferturi dintr-un foton, ci valori specifice de frecvență (ν) sau lungimi de undă (λ).
Odată ce electronul este excitat, acesta nu rămâne timp nelimitat în starea electronică a energiei superioare; eliberează energia sub forma unui foton, iar atomul revine la starea sa bazală sau originală.
În funcție de înregistrarea fotonilor absorbiți, se va obține un spectru de absorbție; iar dacă fotonii emiși sunt înregistrați, atunci rezultatul va fi un spectru de emisie.
Acest fenomen poate fi observat experimental dacă se încălzesc probe gazoase sau atomizate ale unui element. În astronomie, prin compararea acestor spectre, se poate cunoaște compoziția unei stele și chiar locația sa față de Pământ..
Spectru vizibil
Așa cum se poate vedea în primele două imagini, spectrul vizibil include culori de la violet la roșu și toate nuanțele lor cu privire la cât de mult absoarbe materialul (nuanțe întunecate).
Lungimile de undă ale luminii roșii corespund valorilor de la 650 nm încoace (până când dispar în radiația infraroșie). Iar în partea stângă extremă, tonurile violet și violet acoperă valorile lungimii de undă de până la 450 nm. Spectrul vizibil variază apoi de la 400 la 700 nm aproximativ.
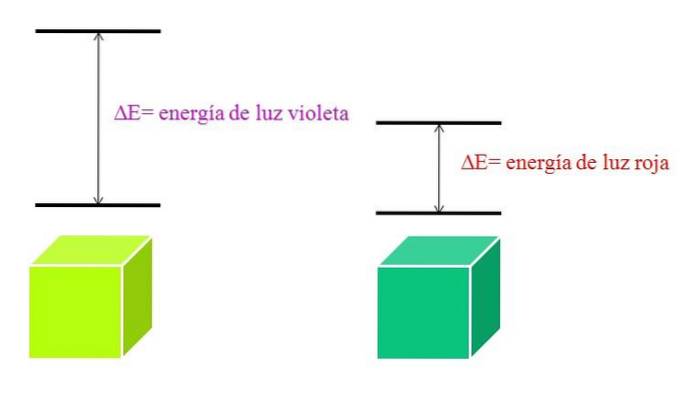
Pe măsură ce λ crește, frecvența fotonului scade și, prin urmare, energia acestuia. Astfel, lumina violetă are o energie mai mare (lungimi de undă mai mici) decât lumina roșie (lungimi de undă mai lungi). Prin urmare, un material care absoarbe lumina purpurie implică tranziții electronice ale energiilor superioare..
Și dacă materialul absoarbe culoarea violet, ce culoare va reflecta? Va apărea o culoare galben-verzuie, ceea ce înseamnă că electronii săi fac tranziții foarte energice; în timp ce dacă materialul absoarbe culoarea roșie cu energie mai mică, acesta va reflecta o culoare verde-albăstruie.
Când un atom este foarte stabil, în general prezintă stări electronice foarte îndepărtate în energie; și, prin urmare, va trebui să absorbiți fotoni cu energie mai mare pentru a permite tranziții electronice:
Spectrul de absorbție al moleculelor
Moleculele au atomi, iar acestea absorb și radiațiile electromagnetice; cu toate acestea, electronii lor fac parte din legătura chimică, deci tranzițiile lor sunt diferite. Unul dintre marile triumfe ale teoriei orbitalelor moleculare este puterea de a relaționa spectrele de absorbție cu structura chimică.
Astfel, legăturile simple, duble, triple, conjugate și structurile aromatice, au propriile lor stări electronice; și, prin urmare, absorb fotoni foarte specifici.
Având mai mulți atomi, pe lângă interacțiunile intermoleculare și vibrațiile legăturilor lor (care absorb și energie), spectrele de absorbție ale moleculelor au forma „munților”, care indică benzile care cuprind lungimile de undă unde au loc tranziții electronice.
Datorită acestor spectre, un compus poate fi caracterizat, identificat și chiar, prin analize multivariate, cuantificat.
Albastru de metil
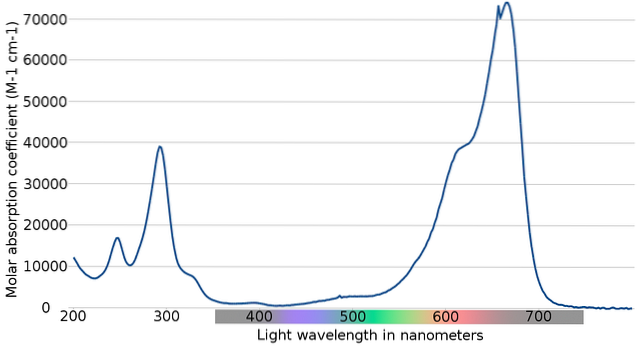
Imaginea superioară arată spectrul indicatorului albastru de metilen. După cum indică evident numele său, este de culoare albastră; dar, poate fi verificat prin spectrul său de absorbție?
Rețineți că există benzi între lungimile de undă de 200 și 300 nm. Între 400 și 500 nm nu există aproape nici o absorbție, adică nu absoarbe culorile violet, albastru sau verde.
Cu toate acestea, are o bandă puternică de absorbție după 600 nm și, prin urmare, are tranziții electronice cu energie redusă, care absorb fotonii de lumină roșie..
În consecință, și având în vedere valorile ridicate ale absorbabilității molare, albastrul de metilen prezintă o culoare albastră intensă..
Clorofilele a și b
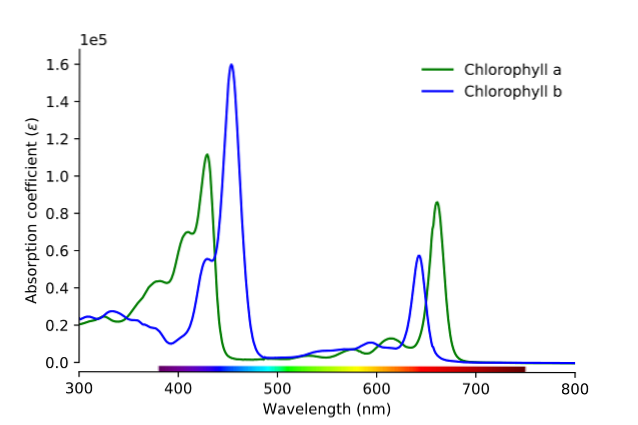
După cum se poate vedea în imagine, linia verde corespunde spectrului de absorbție al clorofilei a, în timp ce linia albastră corespunde cu cea a clorofilei b.
În primul rând, benzile în care absorbtivitatea molară sunt mai mari trebuie comparate; în acest caz, cele din stânga, între 400 și 500 nm. Clorofila a absoarbe puternic culorile violet, în timp ce clorofila b (linia albastră) absoarbe culorile albastre.
Prin absorbția clorofilei b în jurul valorii de 460 nm, se reflectă culoarea albastră, galbenă. Pe de altă parte, absoarbe puternic aproape 650 nm, lumina portocalie, ceea ce înseamnă că prezintă culoarea albastră. Dacă se amestecă galben și albastru, care este rezultatul? Culoarea verde.
Și, în cele din urmă, clorofila a absoarbe culoarea albastru-violet și, de asemenea, o lumină roșie de aproape 660 nm. Prin urmare, prezintă o culoare verde „înmuiată” de galben..
Referințe
- Observatoire de Paris. (s.f.). Diferitele clase de spectre. Recuperat de la: media4.obspm.fr
- Campusul Universității Rabanales. (s.f.). Spectrofotometrie: spectre de absorbție și cuantificare colorimetrică a biomoleculelor. [PDF]. Recuperat de pe: uco.es
- Day, R. și Underwood, A. (1986). Chimie analitică cantitativă (ediția a cincea). PEARSON, Prentice Hall, p 461-464.
- Reush W. (s.f.). Spectroscopie vizibilă și ultravioletă. Recuperat de la: 2.chemistry.msu.edu
- David Darling. (2016). Spectrul de absorbție. Recuperat de la: daviddarling.info
- Academia Khan. (2018). Linii de absorbție / emisie. Recuperat de pe: khanacademy.org



Nimeni nu a comentat acest articol încă.