
Metil sau grupare metil
metil sau grupare metil este un substituent alchil a cărui formulă chimică este CH3. Este cel mai simplu dintre toți substituenții carbonului din chimia organică, are un singur carbon și trei hidrogeni; derivă din gazul metan. Deoarece se poate lega doar de un alt carbon, poziția sa indică sfârșitul unui lanț, încetarea acestuia.
În imaginea de mai jos există una dintre numeroasele reprezentări pentru acest grup. Curbele din dreapta indică faptul că în spatele legăturii H.3C- poate fi orice atom sau substituent; un alchil, R, aromatic sau arii, Ar sau un heteroatom sau o grupare funcțională, cum ar fi OH sau Cl.

Când grupul funcțional atașat la metil este OH, avem alcool metanol, CH3OH; iar dacă este Cl, atunci vom avea clorură de metil, CH3Cl. În nomenclatura organică este denumită pur și simplu „metil” precedată de numărul poziției sale în cel mai lung lanț de carbon.
Grupul metil CH3 este ușor de identificat în timpul elucidărilor structurilor organice, în special datorită spectroscopiei de rezonanță magnetică nucleară din carbon 13 (RMN C13). Din acesta, după oxidări puternice, se obțin grupe de acid COOH, fiind o cale sintetică de sintetizare a acizilor carboxilici.
Indice articol
- 1 Reprezentări
- 2 Structura
- 3 Proprietăți
- 4 Reactivitate
- 4.1 Oxidări
- 4.2 Ioni
- 4.3 Reacția de metilare
- 5 Referințe
Reprezentări
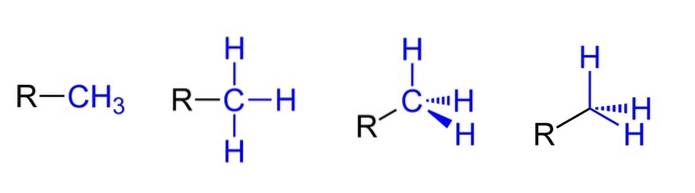
Mai sus avem cele patru reprezentări posibile presupunând că CH3 este legat de un substituent alchil R. Toate sunt echivalente, dar în timp ce mergem de la stânga la dreapta aspectele spațiale ale moleculei sunt evidente.
De exemplu, R-CH3 dă impresia că este plat și liniar. Reprezentarea care urmează prezintă cele trei legături covalente C-H, care permit identificarea metilului în orice structură Lewis și dau impresia falsă că este o cruce..
Apoi, continuând spre dreapta (penultimul), se observă hibridizarea sp3 pe carbonul CH3 datorită geometriei sale tetraedrice. În ultima reprezentare, simbolul chimic pentru carbon nici măcar nu este scris, dar tetraedrul este păstrat pentru a indica ce atomi de H se află în fața sau în spatele planului..
Deși nu este în imagine, un alt mod foarte recurent atunci când reprezintă CH3 constă în simpla plasare a cratimei (-) „gol”. Acest lucru este foarte util atunci când desenezi schelete mari de carbon..
Structura

Imaginea de sus este reprezentarea tridimensională a primei. Sfera neagră lucioasă corespunde atomului de carbon, în timp ce cele albe sunt atomii de hidrogen.
Din nou, carbonul are un produs de mediu tetraedric al hibridizării sale sp3, și ca atare este o grupare relativ voluminoasă, cu rotațiile sale de legătură C-R împiedicate steric; adică nu se poate roti deoarece sferele albe ar interfera cu norii electronici ai atomilor vecini și ar simți repulsia lor.
Cu toate acestea, legăturile C-H pot vibra, la fel ca legătura C-R. Prin urmare, CH3 este un grup de geometrie tetraedrică care poate fi elucidată (determinată, constatată) prin spectroscopie cu radiații infraroșii (IR), ca toate grupurile funcționale și legăturile de carbon cu heteroatomi.
Cu toate acestea, cel mai important lucru este elucidarea sa de către RMN-C.13. Datorită acestei tehnici, se determină cantitatea relativă de grupări metil, care permite asamblarea structurii moleculare..
În general, cu atât mai multe grupuri CH3 au o moleculă, cu atât mai „neîndemânatică” sau mai ineficientă vor fi interacțiunile sale intermoleculare; adică cu cât punctele lor de topire și fierbere vor fi mai mici. Grupuri CH3, datorită hidrogenilor lor, ei „alunecă” unul împotriva celuilalt atunci când se apropie sau se ating.
Proprietăți
Gruparea metil este caracterizată prin faptul că este în esență hidrofobă și apolară.
Acest lucru se datorează faptului că legăturile lor C-H nu sunt foarte polare datorită diferenței reduse dintre electronegativitățile carbonului și hidrogenului; Mai mult, geometria sa tetraedrică și simetrică își distribuie densitățile de electroni aproape omogen, ceea ce contribuie la un moment dipol neglijabil..
În absența polarității, CH3 „Fug” de apă, comportându-se ca un hidrofob. Prin urmare, dacă se vede într-o moleculă, se va ști că acest capăt metilic nu va interacționa eficient cu apa sau cu alt solvent polar..
O altă caracteristică a CH3 este stabilitatea sa relativă. Cu excepția cazului în care atomul legat de acesta își îndepărtează densitatea electronică, rămâne practic inert față de mediul acid foarte puternic. Cu toate acestea, se va vedea că poate participa la reacții chimice, în principal în ceea ce privește oxidarea sau migrarea (metilarea) către o altă moleculă..
Reactivitate
Oxidări
CH3 nu este scutit de ruginire. Aceasta înseamnă că este susceptibil să formeze legături cu oxigenul, C-O, dacă reacționează cu agenți oxidanți puternici. Pe măsură ce se oxidează, se transformă în diferite grupuri funcționale.
De exemplu, prima sa oxidare dă naștere grupării metiol (sau hidroximetil), CHDouăOH, un alcool. Al doilea derivă din gruparea formil, CHO (HC = O), o aldehidă. Iar al treilea, în cele din urmă, permite conversia acestuia în grupa carboxil, COOH, un acid carboxilic.
Această serie de oxidări este utilizată pentru a sintetiza acidul benzoic (HOOC-C6H5) din toluen (H3DC6H5).
Ion
CH3 în timpul mecanismului unor reacții poate câștiga sarcini electrice de moment. De exemplu, atunci când metanolul este încălzit într-un mediu acid foarte puternic, în absența teoretică a nucleofililor (căutători de sarcini pozitive), cationul metilic, CH3+, întrucât legătura CH este ruptă3-OH și OH pleacă cu perechea de electroni a legăturii.
Specia CH3+ este atât de reactiv încât a fost determinat doar în faza gazoasă, deoarece reacționează sau dispare la cea mai mică prezență a unui nucleofil.
Pe de altă parte, CH3 se poate obține și un anion: metanidă, CH3-, cel mai simplu carbanion dintre toate. Cu toate acestea, ca și cap3+, prezența sa este anormală și apare numai în condiții extreme.
Reacție de metilare
În reacția de metilare, se transferă un CH3 la o moleculă fără a produce sarcini electrice (CH3+ nici CH3-) în procesul. De exemplu, iodură de metil, CH3I, este un bun agent de metilare și poate înlocui legătura O-H a mai multor molecule cu un O-CH3.
În sinteza organică, aceasta nu implică nicio tragedie; dar da când ceea ce este metilat în exces sunt bazele azotate ale ADN-ului.
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Rahul Gladwin. (23 noiembrie 2018). Metilare. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Danielle Reid. (2019). Grupa Metil: Structură și Formula. Studiu. Recuperat de la: study.com
- Wikipedia. (2019). Grupa metil. Recuperat de pe: en.wikipedia.org



Nimeni nu a comentat acest articol încă.