
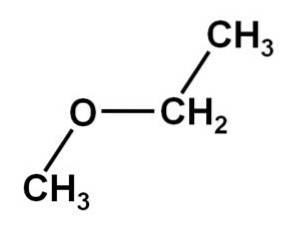
Structura metoxietanului, proprietăți, obținere, utilizări, riscuri

metoxietan Este un compus organic din familia eterilor sau alcoolilor. Formula sa chimică este CH3OCHDouăCH3. Se mai numește metil etil eter sau etil metil eter. Este un compus gazos la temperatura camerei și molecula sa are două grupări metil -CH3, unul atașat direct de oxigen și celălalt de etil -CHDouăCH3.
Metoxietanul este un gaz incolor, solubil în apă și miscibil cu eter și alcool etilic. Deoarece este un eter, este un compus slab reactiv, cu toate acestea, poate reacționa la temperaturi ridicate cu unii acizi concentrați..
Se obține în general prin așa-numita sinteză Williamson, care cuprinde utilizarea unui alcoxid de sodiu și a unui iodură de alchil. La rândul său, descompunerea sa a fost studiată în diferite condiții.
Metoxietanul este utilizat în laboratoare de cercetare cu diverse obiective, de exemplu, în studiul nanomaterialelor semiconductoare sau în observarea materiei interstelare în constelații și în nori moleculari mari ai universului..
De fapt, datorită telescoapelor foarte sensibile (interferometre) a fost detectat în anumite locuri din spațiul interstelar..
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți fizice
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Punct de aprindere
- 3.6 Temperatura de autoaprindere
- 3.7 Greutate specifică
- 3.8 Indicele de refracție
- 3.9 Solubilitate
- 4 Proprietăți chimice
- 4.1 Descompunerea căldurii
- 4.2 Descompunerea fotosensibilizată
- 5 Obținerea
- 6 Amplasarea în univers
- 7 Utilizări de metoxietan
- 7.1 Pentru studii asupra materiei interstelare
- 7.2 Pentru a deduce transformări chimice în diferite domenii de studiu
- 7.3 Utilizarea potențială în semiconductori
- 8 Riscuri
- 9 Referințe
Structura
Compusul metoxietan are o grupare metil -CH3 și o grupare etil -CHDouăCH3 ambii atașați de un oxigen.
După cum se poate observa, în această moleculă există două grupări metil, una atașată la oxigenul CH3-O și celălalt aparținând etil -CHDouă-CH3.
În sol sau cu energie inferioară starea grupării metil a -CHDouă-CH3 este în poziție trans în ceea ce privește metilul legat de oxigen, adică într-un loc diametral opus, luând ca referință legătura CHDouă-O. De aceea se numește uneori trans-etil metil eter.
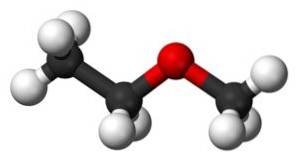
Această moleculă poate suferi răsucire la legătura CHDouă-Sau, care plasează metilul într-o poziție spațială diferită de cea a trans , grupări metil -CH3 sunt foarte apropiate unele de altele și această torsiune generează o tranziție energetică detectabilă de instrumente sensibile.
Nomenclatură
- Metoxietan.
- Eter metil etilic.
- trans-Eter metil eter (în principal în literatura de limbă engleză, traducere din engleză trans-etil metil eter).
Proprietăți fizice
Starea fizică
Gaz incolor
Greutate moleculară
60,096 g / mol
Punct de topire
-113,0 ºC
Punct de fierbere
7,4 ºC
Punct de aprindere
1,7 ºC (metoda cupei închise).
Temperatură de autoaprindere
190 ºC
Greutate specifică
0,7251 la 0 ° C / 0 ° C (Este mai puțin dens decât apa, dar mai greu decât aerul).
Indicele de refracție
1,3420 la 4 ° C
Solubilitate
Solubil în apă: 0,83 mol / L
Solubil în acetonă. Miscibil cu alcool etilic și eter etilic.
Proprietăți chimice
Metoxietanul este un eter, deci este relativ nereactiv. Legătura C-O-C carbon-oxigen-carbon este foarte stabilă împotriva bazelor, agenților oxidanți și reducători. Este degradat doar de acizi, dar se desfășoară numai în condiții viguroase, adică cu acizi concentrați și temperaturi ridicate..
Cu toate acestea, tinde să se oxideze în prezența aerului, formând peroxizi instabili. Dacă recipientele care îl conțin sunt expuse la căldură sau foc, acestea explodează violent.
Descompunerea căldurii
Când metoxietanul este încălzit între 450 și 550 ° C, acesta se descompune în acetaldehidă, etan și metan. Această reacție este catalizată de prezența iodurii de etil, care este prezentă în general în probele de metoxietan de laborator, deoarece este utilizată pentru obținerea acesteia..
Descompunere fotosensibilizată
Metoxietanul iradiat cu o lampă cu vapori de mercur (lungime de undă 2537 Å) se descompune generând o mare varietate de compuși, inclusiv: hidrogen, 2,3-dimetoxibutan, 1-etoxi-2-metoxipropan și metil vinil eter..
Produsele finale depind de timpul de iradiere al probei, deoarece pe măsură ce iradierea continuă, cele care se formează inițial dau naștere la noi compuși..
Prin prelungirea timpului de iradiere, se pot forma, de asemenea, propan, metanol, etanol, acetonă, 2-butanonă, monoxid de carbon, eter etil-n-propilic și eter metil-sec-butilic..
Obținerea
Fiind un eter nesimetric, metoxietanul poate fi obținut prin reacția dintre metoxidul de sodiu CH3ONa și iodură de etil CH3CHDouăI. Acest tip de reacție se numește sinteză Williamson.
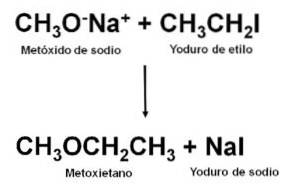
Odată ce reacția a fost efectuată, amestecul este distilat pentru a obține eterul.
De asemenea, poate fi obținut folosind CH etoxid de sodiu3CHDouăONa și sulfat de metil (CH3)DouăSW4.
Amplasarea în univers
trans-Eterul etil metilic a fost detectat în mediul interstelar în regiuni precum constelația Orion KL și în norul molecular gigant W51e2.

Detectarea acestui compus în spațiul interstelar împreună cu analiza abundenței acestuia ajută la construirea de modele de chimie interstelară..
Utilizări de metoxietan
Metoxietanul sau eterul metil etilic este utilizat mai ales în experimente de laborator pentru cercetări științifice.
Pentru studii asupra materiei interstelare
Fiind o moleculă organică cu rotații interne, metoxietanul este un compus chimic de interes pentru studiile materiei interstelare..
Rotațiile interne ale grupărilor sale metil produc tranziții de energie în regiunea microundelor.
Prin urmare, pot fi detectate de telescoape extrem de sensibile, cum ar fi Ansamblul Atacama Large Millimeter / submillimeter, sau ALMA. Atacama Large Millimetru / submilimetru Array).

Datorită rotației sale interne și observatoarelor spațiale mari trans-Eterul metil etilic a fost găsit în constelația Orion și în norul molecular gigant W51e2.
Pentru a deduce transformări chimice în diferite domenii de studiu
Unii cercetători au observat formarea de metoxietan sau metil etil eter atunci când un amestec de etilenă CH este iradiat cu electroni.Două= CHDouă și metanol CH3Oh.
Mecanismul de reacție trece prin formarea radicalului CH3O •, care atacă legătura dublă bogată în electroni a CHDouă= CHDouă. Aductul rezultat CH3-O-CHDouă-CHDouă• captează un hidrogen dintr-un CH3OH și formează metil etil eterul CH3-O-CHDouă-CH3.
Studiul acestui tip de reacții induse de iradierea electronilor este util în domeniul biochimiei, deoarece s-a stabilit că pot provoca daune ADN-ului sau în domeniul chimiei organometalice, deoarece favorizează formarea nanostructurilor..
În plus, se știe că cantități mari de electroni secundari sunt produse atunci când radiațiile electromagnetice sau particule interacționează cu materia condensată în spațiu..
Prin urmare, se estimează că acești electroni pot iniția transformări chimice în materia de praf interstelar. De aici și importanța studierii metil etil eterului în aceste reacții..
Utilizarea potențială în semiconductori
Prin metode de calcul de calcul unii oameni de știință au descoperit că metoxietanul sau metil etil eterul pot fi adsorbiți de grafen dopat cu galiu (Ga) (rețineți că adsorbția este diferită de absorbție).
Grafenul este un nanomaterial format din atomi de carbon care sunt dispuși într-un model hexagonal..

Adsorbția metoxietanului pe grafen dopat are loc prin interacțiunea dintre oxigenul din eter și atomul de galiu de pe suprafața nanomaterialului. Datorită acestei adsorbții există un transfer net de încărcare de la eter la galiu..
După adsorbția eterului metil etilic și datorită acestui transfer de încărcare, grafenul dopat cu galiu prezintă proprietăți semiconductoare de tip p.
Riscuri
Metoxietanul este foarte inflamabil.
La contactul cu aerul are tendința de a forma peroxizi instabili și explozivi.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Etil metil eter. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Irvine W.M. (2019) Etil metil eter (CDouăH5OCH3). În: Gargaud M. și colab. (eds). Enciclopedia Astrobiologiei. Springer, Berlin, Heidelberg. Recuperat de pe link.springer.com.
- În al treilea rând, B. și colab. (2015). Se caută eter metil eter trans în Orion KL. Astronomie și astrofizică. 582, L1 (2015). Recuperat de la ncbi.nlm.nih.gov.
- Filseth, S.V. (1969). Mercurul 6 (3P1) Descompunerea fotosensibilizată a eterului metil etilic. Jurnalul de chimie fizică. Volumul 73, numărul 4, aprilie 1969, 793-797. Recuperat de la pubs.acs.org.
- Casanova, J.Jr. (1963). Pregătirea studentului și manipularea unui gaz-metil etil eter. Journal of Chemical Education. Volumul 40, numărul 1, ianuarie 1963. Recuperat de la pubs.acs.org.
- Ure, W. și Young, J.T. (1933a). Despre mecanismul reacțiilor gazoase. I. Descompunerea termică a eterului metil etilic. Jurnalul de chimie fizică, vol. XXXVII, nr. 9: 1169-1182. Recuperat de la pubs.acs.org.
- Ure, W. și Young, J.T. (1933b). Despre mecanismul reacțiilor gazoase. II. Cataliza omogenă în descompunerea eterului metil etilic. Jurnalul de chimie fizică, 37, 9, 1183-1190. Recuperat de la pubs.acs.org.
- Shokuhi Rad, A. și colab. (2017). Studiu DFT privind adsorbția dietil, etil metil și dimetil eteri pe suprafața grafenului dopat cu Gallium. Știința aplicată a suprafeței. Volumul 401, 15 aprilie 2017, paginile 156-161. Recuperat de la sciencedirect.com.
- Schmidt, F. și colab. (2019). Formarea indusă de electroni a etil metil eterului în amestecuri condensate de metanol și etilenă. J. Phys. Chem. A 2019, 123, 1, 37-47. Recuperat de la pubs.acs.org.


Nimeni nu a comentat acest articol încă.