
Tipuri de miofilamente, structură și organizare
miofilamente sunt proteinele contractile ale miofibrilelor, care sunt unitățile structurale ale celulelor musculare, celule alungite care se numesc fibre musculare.
Fibrele musculare și componentele lor au denumiri speciale. De exemplu, membrana, citoplasma, mitocondriile și reticulul endoplasmatic sunt cunoscute sub numele de sarcolemă, sarcoplasmă, sarcozomi și, respectiv, reticul sarcoplasmatic..
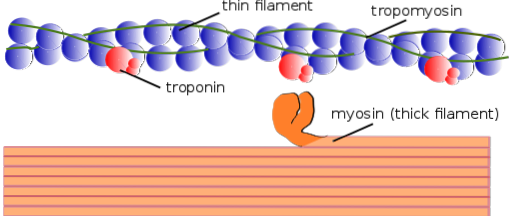
În același mod, elementele contractile din interior sunt denumite în comun miofibrile; iar proteinele contractile care alcătuiesc miofibrilele se numesc miofilamente.
Există două tipuri de miofilamente: subțire și groasă. Filamentele subțiri sunt formate în principal din trei proteine: F-actină, tropomiozină și troponină. Între timp, filamentele groase sunt formate exclusiv dintr-o altă proteină cunoscută sub numele de miozină II.
În plus față de acestea, există și alte proteine asociate atât cu filamente groase, cât și subțiri, dar acestea nu au funcții contracționale, ci mai degrabă structurale, printre care, pentru a numi câteva, titina și nebulina.
Indice articol
- 1 Tipuri de fibre musculare
- 2 Structura
- 2.1 Miofilamente subțiri
- 2.2 Miofilamente groase
- 3 Organizare
- 3.1 Cum sunt organizate miofilamentele în cadrul sarcomerilor?
- 4 Mecanismul de contracție
- 5 Referințe
Tipuri de fibre musculare
Aranjamentul particular al miofilamentelor care alcătuiesc miofibrilele dă naștere la două tipuri de fibre musculare: fibrele musculare striate și fibrele musculare netede.
Fibrele musculare striate, atunci când sunt examinate la microscopul cu lumină, prezintă un model de striații sau benzi transversale care se repetă pe toată suprafața lor și care dau numele, mușchiului care le conține, de mușchi striat. Există două tipuri de fibre musculare striate, scheletale și cardiace.
Fibrele musculare care nu prezintă acest model de benzi transversale se numesc fibre netede. Sunt cei care alcătuiesc mușchii pereților vasculari și ai viscerelor.
Structura
Miofilamente subțiri
Aceste miofilamente sunt compuse din actină F și două proteine asociate: tropomiozina și troponina, care au funcții de reglare..
Actina F sau actina filamentoasă este un polimer al unei alte proteine globulare mai mici numită actină G sau actină globulară, cu o greutate moleculară de aproximativ 42 kDa. Are un situs de legare pentru miozină și este aranjat prin formarea a două lanțuri dispuse ca o helică dublă compusă din aproximativ 13 monomeri pe tură..
Filamentele de F-actină se caracterizează prin prezența a doi poli: unul pozitiv, îndreptat spre discul Z, iar celălalt negativ, dispus spre centrul sarcomerului.
Tropomiozina este, de asemenea, alcătuită dintr-un lanț dublu polipeptidic cu dublu helix. Este o proteină de 64 kDa care formează filamente care sunt situate în canelurile lăsate de lanțurile dublei spirale ale filamentelor subțiri de F-actină, ca și cum ar „umple” spațiile goale din helix.
În repaus, tropomiozina acoperă sau „acoperă” locurile de legare ale actinei pentru miozină, prevenind interacțiunea ambelor proteine, ceea ce cauzează contracția musculară. În jurul fiecărui filament subțire și la aproximativ 25-30m de la începutul fiecărei tropomiozine se află o altă proteină numită troponină.
Troponina (Tn) este un complex proteic compus din trei subunități polipeptidice globulare numite troponina T, C și I. Fiecare moleculă de tropomiozină are un complex de troponină asociat care o reglează și, împreună, sunt responsabile de reglarea inițierii și terminării..
Miofilamente groase
Filamentele groase sunt polimeri ai miozinei II, cântărind 510 kDa și constând din două lanțuri grele de câte 222 kDa și patru lanțuri ușoare. Lanțurile ușoare sunt de două tipuri: lanțuri ușoare esențiale de 18 kDa și lanțuri ușoare de reglare de 22 kDa..
Fiecare lanț greu de miozină II are forma unei tije cu un cap globular mic la capătul său care proiectează aproape 90⁰ și are două situri de legare, unul pentru actină și unul pentru ATP. Acesta este motivul pentru care aceste proteine aparțin familiei ATPazei..
Un filament gros este format din mai mult de 200 de molecule de miozină II. Capul globular al fiecăreia dintre aceste molecule acționează ca o „paletă” în timpul contracției, împingând actina de care este atașat, astfel încât să alunece spre centrul sarcomerului..
Organizare
Într-o fibră musculară scheletată, miofibrilele ocupă cea mai mare parte a sarcoplasmei și sunt aranjate în ansambluri longitudinale și ordonate în întreaga celulă.
Într-o secțiune longitudinală văzută cu un microscop optic, se observă benzi luminoase, numite benzi I, și benzi întunecate, numite benzi A. Aceste benzi corespund aranjării ordonate a miofibrilelor și, prin urmare, a miofilamentelor care le compun..
În centrul benzii I există o linie întunecată și subțire numită disc Line sau Z. Centrul fiecărei benzi A are o zonă mai deschisă cunoscută sub numele de banda H, care este împărțită central printr-o linie mai întunecată numită linia M.
Delimitată între două linii Z, este descrisă o structură numită sarcomer, care este unitatea funcțională a mușchiului scheletic. Un sarcomer este compus din miofilamente contractile dispuse în mod ordonat în benzile A, H și o semi-bandă I la fiecare capăt..
Benzile I conțin doar filamente subțiri, banda A conține filamente groase împletite la cele două capete ale acestora cu filamente fine, iar banda H conține doar filamente groase.
Cum sunt organizate miofilamentele în cadrul sarcomerilor?
Atât miofilamentele groase, cât și cele subțiri pot fi observate atunci când se examinează o probă de mușchi scheletic scheletic la microscopul electronic. Se spune că acestea se „interdigitează” sau „se împletesc” între ele într-un aranjament secvențial, ordonat și paralel..
Filamentele subțiri provin din discurile Z și se extind de ambele părți în direcția opusă și spre centrul fiecărui sarcomer adiacent. De pe discurile Z de la fiecare capăt al sarcomerului, în mușchi relaxat, actina se deplasează până la începutul benzii H pe fiecare parte.
Astfel, în fibrele musculare ale mușchilor scheletici relaxați miofilamentele groase ocupă zona centrală care formează benzile întunecate sau benzile A; iar filamentele subțiri se extind de ambele părți ale sarcomerului fără a ajunge în centrul sarcomerului.
Într-o secțiune transversală din regiunea în care se suprapun filamentele groase și subțiri, se poate observa un model hexagonal care include filamentul gros în centru și șase filamente subțiri care îl înconjoară și care sunt situate în fiecare dintre marginile hexagonului.
Această organizare a miofilamentelor în sarcomer este păstrată de funcția unei serii de proteine asociate miofilamentelor și care au funcții structurale, printre care se pot evidenția titina, alfa-actina, nebulina, miomesina și proteina C..
Mecanismul de contracție
Când acetil colina (un neurotransmițător) este eliberat în placa neuromusculară prin stimularea unui neuron motor, fibra musculară este excitată și se deschid canalele de calciu cu tensiune ale reticulului sarcoplasmatic.
Calciul se leagă de troponina C și acest lucru determină o schimbare conformațională a tropomiozinei, care expune siturile active ale actinei, inițind astfel contracția. Când nivelurile de calciu scad, tropomiozina revine la poziția sa inițială și contracția încetează..
Expunerea siturilor de legare a actinei la miozină permite ambelor proteine să se lege și miozina să împingă actina spre centrul sarcomerului, alunecând peste miozină.
În timpul contracției musculare, liniile Z ale fiecărui sarcomer se apropie de centru, apropiindu-se de linia M, crescând interdigitația dintre actină și miozină și reducând dimensiunea benzilor I și H. Gradul de scurtare va depinde de însumarea scurtării. a fiecăruia dintre sarcomeri ai mușchiului contractat.
Referințe
- Berne, R. și Levy, M. (1990). Fiziologie. Mosby; Ediție internațională.
- Fox, S. I. (2006). Fiziologia umană (Ed. A 9-a). New York, SUA: McGraw-Hill Press.
- Gartner, L. și Hiatt, J. (2002). Text Atlas histologie (Ed. A 2-a). México D.F.: McGraw-Hill Interamericana Editores.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V. și Weil, P. (2009). Biochimia ilustrată a lui Harper (Ed. 28). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biochimie. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, M. și Pawlina, W. (2006). Histologie. Un text și un atlas cu celule corelate și biologie moleculară (Ed. A 5-a). Lippincott Williams și Wilkins.
- West, J. (1998). Baza fiziologică a practicii medicale (Ediția a XII-a). México D.F.: Editorial Médica Panamericana.



Nimeni nu a comentat acest articol încă.