
Structura mioglobinei, funcția, valorile normale
mioglobina Este o proteină intracelulară globulară care se găsește în citosolul celulelor musculare scheletice și cardiace. Funcția sa fundamentală este de a constitui o rezervă de oxigen și de a promova transportul intracelular de oxigen..
John Kendrew și Max Perutz au primit Premiul Nobel pentru chimie în 1962 pentru studiile lor asupra proteinelor globulare. Acești autori au elucidat structura tridimensională a mioglobinei și, respectiv, a hemoglobinei. Din punct de vedere istoric, mioglobina a fost una dintre primele proteine din care sa determinat structura tridimensională..
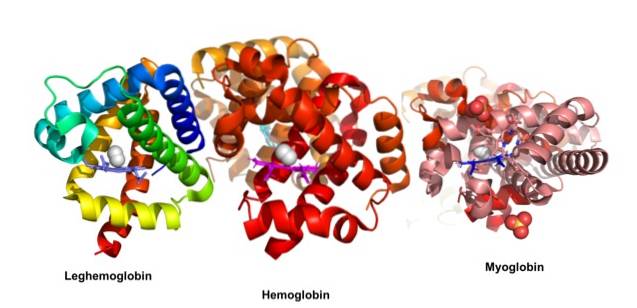
Proteinele globulare sunt molecule compacte cu formă sferică; sunt solubile în citosol sau în porțiunea lipidică a membranelor celulare. Acestea sunt responsabile de principalele acțiuni biologice, spre deosebire de proteinele fibroase, ale căror funcții principale sunt structurale.
Mioglobina conferă cărnii proaspete culoarea roșie. Acest lucru se întâmplă atunci când mioglobina este oxigenată ca oximioglobină și fierul care o compune este sub formă de fier fier: Mb-Fe2 + O2.
Când carnea este expusă mediului înconjurător, fierul feros instabil se oxidează și devine feric și în aceste condiții culoarea se schimbă în tonuri de maro datorită formării metamoglobinei (Mb-Fe3 + + O2 ● -).
În mod normal, nivelurile de mioglobină din sânge sunt foarte mici, de ordinul microgramei pe litru (μg / L). Aceste niveluri cresc atunci când are loc distrugerea musculară ca în rabdomioliza mușchilor scheletici sau în infarctul cardiac cu distrugerea țesuturilor și în unele miopatii..
Prezența sa în urină este observată în anumite condiții în care deteriorarea țesuturilor este foarte importantă. Valoarea sa de diagnostic precoce pentru infarct este discutabilă.
Indice articol
- 1 Structura mioglobinei
- 2 Funcția
- 2.1 Tipuri de fibre musculare și mioglobină
- 3 valori normale
- 4 Referințe
Structura mioglobinei
Mioglobina are o greutate moleculară de aproape 18 kDa, inclusiv grupul hem. Este alcătuit din patru segmente elicoidale unite prin „viraje ascuțite”. Aceste spirale de mioglobină sunt strâns ambalate și își mențin integritatea structurală chiar și atunci când grupul hem este îndepărtat..
Structura proteinelor globulare, precum și a tuturor proteinelor celulare, este ierarhică, astfel încât structura mioglobinei este, de asemenea, ierarhizată. Primul nivel este structura primară formată din secvența liniară a aminoacizilor și mioglobina este constituită dintr-un lanț de 153 aminoacizi..
Structura secundară a mioglobinei constă din conformația elicoidelor alfa. Mioglobina conține 8 helice alfa formate prin repetarea porțiunilor polipeptidice care sunt unite prin segmente scurte de aranjament aperiodic..
Structura terțiară constă din conformația tridimensională cu activitatea biologică. Cele mai importante caracteristici ale acestei structuri sunt pliurile. Structura cuaternară se referă la asamblarea a două sau mai multe lanțuri polipeptidice separate și unite prin legături sau interacțiuni non-covalente..
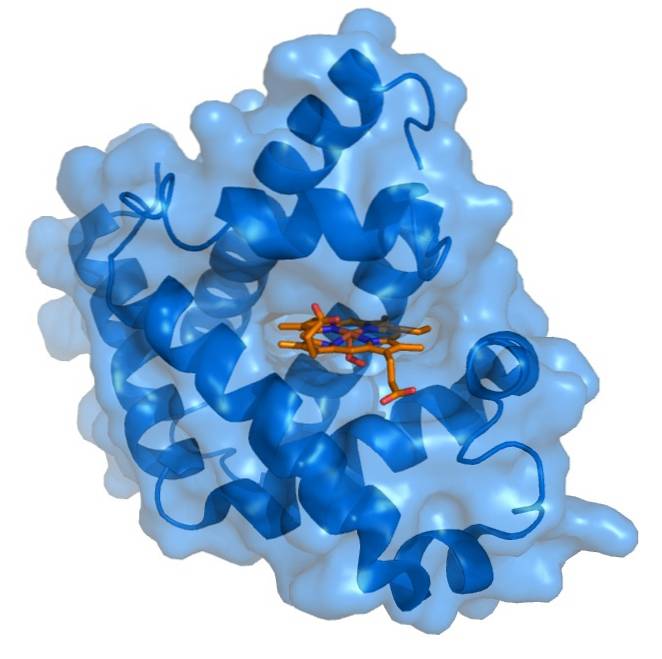
Mioglobina are o structură foarte compactă, cu reziduuri hidrofobe direcționate spre interior și reziduuri hidrofile sau polare direcționate spre exterior. Reziduurile apolare interne sunt alcătuite din leucină, valină, metionină și fenilalanină. Singurele reziduuri polare interne sunt două histidine care au funcții în centrul activ..
Grupa protetică hem este localizată într-o despicătură a părții interioare apolare a lanțului polipeptidic al mioglobinei. Acest grup conține fier sub formă de fier feros, care se leagă de oxigen pentru a forma oximioglobina..
Funcţie
Funcția mioglobinei este de a lega oxigenul de grupul hem al structurii sale și de a forma o rezervă de oxigen pentru funcția musculară. Deoarece oxigenul este prins în structura mioglobinei din citoplasma celulei musculare, presiunea sa intracelulară, determinată de oxigenul liber, rămâne scăzută..
Presiunea scăzută a oxigenului intracelular menține gradientul pentru intrarea oxigenului în celulă. Acest lucru favorizează trecerea oxigenului din sânge către celula musculară. Când mioglobina este saturată, oxigenul intracelular crește, ceea ce scade progresiv gradientul și astfel scade transferul.
Curba de legare a oxigenului la mioglobină este hiperbolică. În porțiunile inițiale ale curbei, mici modificări ale presiunii parțiale a oxigenului produc schimbări mari în saturația mioglobinei cu oxigen..
Apoi, pe măsură ce crește presiunea parțială a oxigenului, saturația continuă să crească, dar mai încet, adică este necesară o creștere mult mai mare a presiunii parțiale a oxigenului pentru a crește saturația mioglobinei, iar progresiv curba este aplatizată.
Există o variabilă care măsoară afinitatea curbei numită P50, aceasta reprezintă presiunea parțială a oxigenului necesară pentru a satura mioglobina conținută într-o soluție cu 50%. Astfel, dacă P50 crește, se spune că mioglobina are o afinitate mai mică și dacă P50 scade, se spune că mioglobina are o afinitate mai mare pentru oxigen..
Când se examinează curbele de legare a oxigenului pentru mioglobină și hemoglobină, se observă că pentru orice presiune parțială de oxigen examinată, mioglobina devine mai saturată decât hemoglobina, indicând faptul că mioglobina are o afinitate mai mare pentru oxigen decât hemoglobina.
Tipuri de fibre musculare și mioglobină
Mușchii scheletici au diferite tipuri de fibre musculare în compoziția lor, unele numite slow-twitch și altele fast-twitch. Fibrele de contracție rapidă sunt adaptate structural și metabolic pentru a se contracta rapid, energic și anaerob.
Fibrele de contracție lentă sunt adaptate pentru contracții mai lente, dar mai lungi, tipice exercițiilor aerobice de rezistență. Una dintre diferențele structurale ale acestor fibre este concentrația mioglobinei, care le dă numele de fibre albe și roșii..
Fibrele roșii au un conținut ridicat de mioglobină, ceea ce le conferă culoarea roșie, dar le permite, de asemenea, să mențină cantități mari de oxigen, ceea ce este esențial pentru funcția lor..
Valorile normale
Valorile normale ale sângelui pentru bărbați sunt de 19 până la 92 µg / l, iar pentru femei de 12 până la 76 µg / l, cu toate acestea, există diferențe în valori în diferite laboratoare..
Aceste valori cresc atunci când are loc distrugerea mușchilor, ca și în rabdomioliza mușchilor scheletici, în arsuri extinse, șocuri electrice sau în necroză musculară extinsă datorată ocluziei arteriale, în infarctul miocardic și în unele miopatii..
În aceste condiții, mioglobina apare în urină și îi conferă o culoare caracteristică..
Referințe
- Fauci, A. S., Kasper, D. L., Hauser, S. L., Jameson, J. L. și Loscalzo, J. (2012). Principiile lui Harrison de medicină internă. D. L. Longo (Ed.). New York: Mcgraw-hill
- Ganong WF: Reglementarea centrală a funcției viscerale, în Revizuirea fiziologiei medicale, Ediția a 25-a. New York, McGraw-Hill Education, 2016.
- Guyton AC, Sala JE: Compartimentele pentru fluidele corporale: fluide extracelulare și intracelulare; Edem, în Manual de fiziologie medicală, Ediția a 13-a, AC Guyton, JE Hall (ed.). Philadelphia, Elsevier Inc., 2016.
- McCance, K. L. și Huether, S. E. (2018). Fiziopatologie-Ebook: baza biologică a bolilor la adulți și copii. Elsevier Health Sciences.
- Murray, R. K., Granner, D. K., Mayes, P. A. și Rodwell, V. W. (2014). Biochimia ilustrată a lui Harper. Mcgraw-hill.



Nimeni nu a comentat acest articol încă.