
Caracteristicile, structura, tipurile și funcția miozinei
miozină este un motor molecular, de natură proteică, capabil să se deplaseze pe filamente de actină din citosol. Energia care determină deplasarea miozinei provine din hidroliza ATP. Din această cauză, miozina este adesea definită ca o enzimă mecanochimică.
În eucariote, miozina este o proteină foarte abundentă. Există diferite clase de miozină, care sunt codificate de o familie de gene. La drojdii se disting 5 clase, în timp ce la mamifere au fost descrise zeci.
Miozina are o mare varietate de funcții. Miozina I, împreună cu actina, participă la mișcarea keratocitelor.
Miozina II asigură rigiditate membranei plasmatice, participă la citokinezie și contracție musculară. Ambele miozine I și II colaborează cu migrarea celulelor. Miozinele I și V efectuează transportul veziculelor de-a lungul filamentelor de actină.
Indice articol
- 1 Structură
- 2 caracteristici
- 3 Funcții
- 3.1 Contracția musculară
- 3.2 Citokinezie
- 3.3 Rigidizarea membranelor corticale
- 3.4 Aderența celulelor
- 3.5 Deplasarea unor vezicule
- 4 Boli legate de miozină
- 4.1 Miozine și pierderea auzului
- 4.2 Miozina X și cancerul
- 5 Referințe
Structura
În micrografiile electronice, structura tipică a izoformelor miozinei are trei domenii: cap, gât și coadă. Prin hidroliza cu chimotripsina, se obține un segment format din cap și gât, numit meromiozină grea (HMM), și un segment al cozii, numit meromiozină ușoară (LMM).
Domeniul capului este capătul N-terminal al lanțului greu, iar domeniul cozii este capătul C-terminal al lanțului ușor.
Clasele miozinei pot fi diferențiate de numărul de lanțuri polipeptidice care o compun și de abundența și clasa lanțului ușor atașat la gât.
Miozina I are un lanț polipeptidic, care formează un cap, iar coada sa nu are regiuni alfa-elicoidale. În timp ce miozinele I și V au două lanțuri polipeptidice și, prin urmare, formează două capete și o coadă, în care lanțurile alfa elicoidale înfășurate pentru a forma o structură asemănătoare tijei.
Miozinele I și V au situsuri de legare pentru calmodulină, care reglează și leagă Ca+Două, pe lanțuri ușoare. Miozina I fixează Ca+Două în lanțuri ușoare, dar o face diferit de calmodulină.
Caracteristici
La nivel mecanochimic, miozinele au trei caracteristici și anume:
- Capul miozinei este domeniul motor care avansează în etape discrete: unirea capului miozinei cu un filament de actină, înclinația acestuia și separarea ulterioară produc mișcarea miozinei. Acest proces este ciclic și depinde de ATP.
- Modificări conforme: hidroliza unei molecule de ATP este cuplată la fiecare pas al unei molecule de miozină, prin niveluri de amplificare și transmisie. Aceasta implică mari schimbări conformaționale ale miozinei..
Primul nivel de amplificare este produs de pierderea grupului gamma-fosfat al ATP, care permite o reorganizare a elementelor structurale în situsul de legare a ATP. Această reorganizare este coordonată cu modificări structurale în situsul de legare a actinei..
Al doilea nivel de amplificare implică comunicarea schimbării conformaționale în locul activ la componentele structurale ale terminalului carboxil..
- Direcționalitate: s-a constatat că miozinele au polaritate sau direcționalitate inversă către capătul (+) al filamentului de actină. Această concluzie vine din experimentele de alunecare a filamentului de actină, folosind microscopul cu lumină fluorescentă..
Caracteristici
Miozina, împreună cu actina, participă la contracția musculară, aderența celulară, citokineză, rigidizarea membranelor corticale și deplasarea unor vezicule, printre alte funcții..
Defectele miozinei pot produce condiții patologice. De exemplu, defectele miozinelor I și V sunt legate, respectiv, de miopatiile miozinice și tulburări de pigmentare (sindromul Griscelli). În timp ce tulburările din izoformele miozinei VI cauzează pierderea auzului.
Contractie musculara
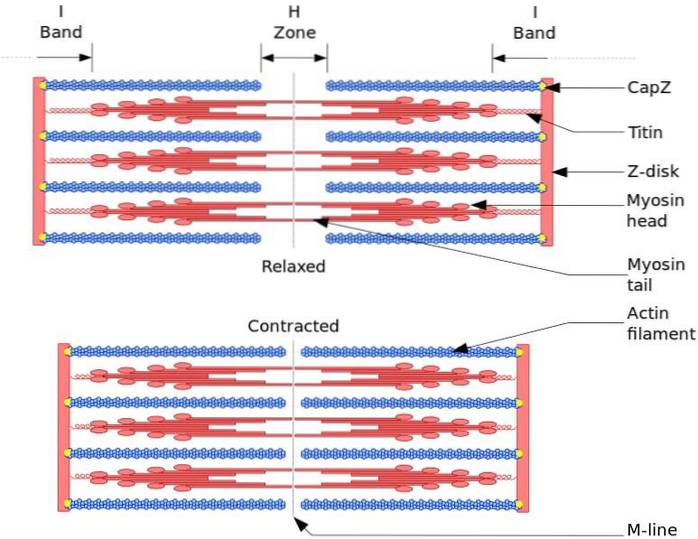
Unitatea funcțională și structurală a mușchiului scheletic este sarcomerul. În timpul contracției musculare, lungimea sarcomerului atinge 30% din lungimea sa inițială.
Sarcomerele sunt formate din filamente groase de miozină și filamente subțiri de actină care sunt organizate într-un mod complex. În general, capetele miozinei sunt situate la capetele distale ale filamentului și cozile lor spre centrul sarcomerului, iar organizația este bipolară.
Pentru ca contracția musculară să apară, capetele de miozină de la capetele opuse trebuie să se deplaseze spre discul Z sau capătul (+) al filamentului. Deoarece organizarea filamentelor groase este bipolară, se produce alunecarea filamentelor subțiri pe filamentele groase, antrenată de ATP.
Forța de deplasare apare deoarece sute de capete de miozină, dintr-un filament gros, interacționează cu un filament subțire.
Citokinezie
În timpul mitozei, când microtubulii de la polii fusului se separă, actina și miozina II formează un inel contractil la ecuatorul celulei. Acest inel se contractă, micșorându-și diametrul și împărțind celula în două părți..
Rigidizarea membranelor corticale
În celulele mutante lipsite de miozină II, membrana plasmatică se deformează ușor atunci când se aplică o forță externă. Acest lucru se întâmplă deoarece miozina II asigură forța de agregare a proteinelor din membrana plasmatică..
Aderenta celulara
În țesutul epitelial, fasciculele contractile de actină și miozină II sunt situate în vecinătatea membranei plasmatice și formează un brâu circular care înconjoară suprafața celulei interioare. Acest brâu circular determină forma celulei și menține legătura dintre celule..
Contactul dintre celule are loc prin unirea centurii circulare cu moleculele de adeziune celulară, prin intermediul proteinelor de unire.
Deplasarea unor vezicule
Dovezile experimentale arată că miozina V efectuează transportul membranei de la aparatul Golgi la periferia celulei. Unele dovezi sunt:
- În celulele țesutului nervos, prin imunofluorescență astrocitară, s-a constatat că mioza V se află lângă Golgi.
- În drojdie, mutațiile genei miozinei V perturbă secreția de proteine și, în consecință, proteinele se acumulează în citosol.
- Izoformele miozinei I sunt responsabile pentru transportul vacuolelor către membrana celulară. Folosind anticorpi specifici împotriva izoformelor miozinei I, s-a constatat că aceste izoforme sunt localizate în diferite părți ale celulei..
De exemplu, când o amibă vie este marcată cu un anticorp împotriva miozinei IC, transportul vacuolului către membrană este oprit. Datorită acestui fapt, vacuolul se extinde și celula izbucnește.
Boli legate de miozină
Miozine și pierderea auzului
Există numeroase gene și mutații care cauzează pierderea auzului. Această boală este frecvent monogenetică .
Mutațiile neconvenționale ale miozinei, cu una sau două capete de miozină, afectează funcționarea urechii interne. Unele dintre izoformele de miozină mutate sunt miozina IIIA, miozina VIIA și miozina XVA. Recent, două mutații au fost descoperite în miozina VI.
Mutațiile din miozina VI sunt c.897G> T și p.926Q. Prima mutație afectează o regiune care interacționează cu site-ul activ, numită Switch I. Homozigotul pentru mutație prezintă fenotipul precoce, provocând efecte severe.
A doua mutație afectează o regiune de reziduuri încărcate, într-o helix alfa din coada miozinei VI. Această regiune este importantă pentru dimerizarea motorului proximal și afectează funcția stereo-ciliară a miozinei VI..
O altă mutație este p.Asn207Ser, care produce un motor incapabil să producă forță. Acest lucru se datorează faptului că Asn 207 este un reziduu de aminoacizi al situsului activ, a cărui funcție este legarea și hidroliza ATP.
Mutația p.Arg657Trp determină pierderea funcției miozinei VI. Reziduul Arg este implicat în schimbările conformaționale care cuplează hidroliza la mișcarea miozinei.
Miozina X și cancerul
Myosin X (Myo10) este o miozină neconvențională care se exprimă în creier, endoteliu și multe epitelii. Myo10 și trei clase de proiecții bazate pe actină (filopodie, invadopodie și proiecții asemănătoare filopodelor) funcționează în timpul metastazei cancerului.
Celulele canceroase invazive au un număr mare de filopodii și exprimă niveluri ridicate de fascină. Această proteină creează legături încrucișate între filamentele de actină. Pentru a scăpa de tumora primară, se formează invadopodii, bogate în activitate proteolitică, care digeră matricea extracelulară înconjurătoare..
Odată ce celulele ajung la matricea extracelulară, proiecțiile asemănătoare filopodelor ajută la dispersare și colonizare. Nivelurile ridicate de Myo10 indică o agresivitate ridicată și metastaze în cancerul de sân.
Silențierea MyoX determină pierderea caracterului metastatic al celulelor, care nu pot forma proiecții pe bază de actină. Toate aceste proiecții au aderențe bazate pe integrină, care sunt purtate de Myo10 în filopod..
MyoX este implicat în formarea centrosomului. Absența MyoX favorizează formarea fusurilor multipolare. MyoX este, de asemenea, implicat în semnalizarea în celulele canceroase. De exemplu, MyoX este activat de 3,4,5, -inozitol trifosfat (PIP3).
Referințe
- Alberts, B., Johnson, A., Lewis, J., și colab. 2007. Biologia moleculară a celulei. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Mutații noi ale miozinei pentru pierderea auzului ereditar dezvăluite prin captarea genomică vizată și secvențierea masivă paralelă. Jurnalul European de Genetică Umană, 22: 768-775.
- Courson, D.S. și Cheney, R.E. 2015. Miozina-X și boala. Cercetări celulare experimentale, 334: 10-15.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biologie celulară și moleculară. Editorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexic, São Paulo.
- Schliwa, M. și Woehlke, G. 2003. Motoare moleculare. Natura, 422: 759-765.
- Bine, R.D. 2003. Cutia de instrumente cu motor molecular pentru transport intracelular. Cell, 112: 467-480.



Nimeni nu a comentat acest articol încă.