
Modelul atomic Heisenberg

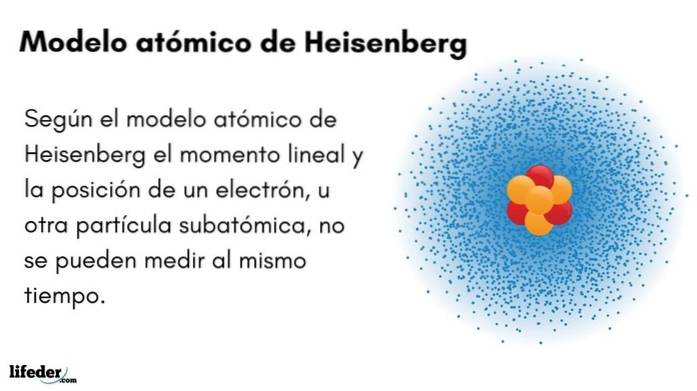
Care este modelul atomic al lui Heisenberg?
Modelul atomic Heisenberg (1927) introduce principiul incertitudinii în orbitalii electronici din jurul nucleului atomic. Reprezentantul fizician german a pus bazele mecanicii cuantice pentru a estima comportamentul particulelor subatomice care alcătuiesc un atom.
Principiul de incertitudine al lui Werner Heisenberg indică faptul că nu este posibil să se cunoască cu certitudine poziția și impulsul liniar al unui electron în același timp. Același principiu se aplică variabilelor timp și energie; adică, dacă avem un indiciu despre poziția electronului, nu vom cunoaște impulsul liniar al electronului și invers.
Pe scurt, nu este posibil să se prezică simultan valoarea ambelor variabile. Cele de mai sus nu implică faptul că oricare dintre cantitățile menționate anterior nu poate fi cunoscută cu precizie. Atâta timp cât este separat, nu există nici un impediment pentru a obține valoarea dobânzii.
Cu toate acestea, incertitudinea apare atunci când vine vorba de a cunoaște simultan două mărimi conjugate, cum ar fi poziția și impulsul liniar, și timpul împreună cu energia..
Acest principiu apare datorită unui raționament strict teoretic, ca singură explicație viabilă care să justifice observațiile științifice.
Caracteristicile modelului atomic Heisenberg

În martie 1927, Heisenberg și-a publicat lucrarea Despre conținutul perceptiv al cinematicii și mecanicii teoretice cuantice, unde ați detaliat principiul incertitudinii sau nedeterminării.
Acest principiu, fundamental în modelul atomic propus de Heisenberg, se caracterizează prin următoarele:
- Principiul incertitudinii apare ca o explicație care completează noile teorii atomice despre comportamentul electronilor. În ciuda utilizării instrumentelor de măsurare cu precizie și sensibilitate ridicate, nedeterminarea este încă prezentă în orice test experimental.
- Datorită principiului incertitudinii, atunci când analizați două variabile conexe, dacă aveți o cunoaștere exactă a uneia dintre acestea, atunci incertitudinea cu privire la valoarea celeilalte variabile va fi din ce în ce mai mare..
- Momentul și poziția unui electron sau a unei alte particule subatomice nu pot fi măsurate în același timp.
- Relația dintre ambele variabile este dată de o inegalitate. Potrivit lui Heisenberg, produsul variațiilor impulsului liniar și poziția particulei este întotdeauna mai mare decât coeficientul dintre constanta Plank (6.62606957 (29) × 10 -3. 4 Jules x secunde) și 4π, așa cum este detaliat în următoarea expresie matematică:

Legenda corespunzătoare acestei expresii este următoarea:
∆p: nedeterminarea momentului liniar.
∆x: nedeterminarea poziției.
h: Constanta lui Plank.
π: numărul pi 3.14.
- Având în vedere cele de mai sus, produsul incertitudinilor are ca limită inferioară raportul h / 4π, care este o valoare constantă. Prin urmare, dacă una dintre mărimi tinde spre zero, cealaltă trebuie să crească în aceeași proporție.
- Această relație este valabilă pentru toate perechile de mărimi canonice conjugate. De exemplu: principiul incertitudinii lui Heisenberg este perfect aplicabil perechii energie-timp, așa cum este detaliat mai jos:
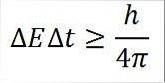
În această expresie:
∆E: nedeterminarea energiei.
∆t: nedeterminarea timpului.
h: Constanta lui Plank.
π: numărul pi 3.14.
- Din acest model rezultă că determinismul cauzal absolut în variabilele canonice conjugate este imposibil, deoarece pentru a stabili această relație ar trebui să existe cunoștințe despre valorile inițiale ale variabilelor de studiu.
- În consecință, modelul Heisenberg se bazează pe formulări probabilistice, datorită aleatoriei care există între variabilele la niveluri subatomice..
Teste experimentale
Principiul incertitudinii Heisenberg apare ca singura explicație posibilă pentru testele experimentale care au avut loc în primele trei decenii ale secolului XXI..
Înainte ca Heisenberg să enunțe principiul incertitudinii, preceptele în vigoare la acel moment au sugerat că variabilele impuls liniar, poziție, moment unghiular, timp, energie, printre altele, pentru particulele subatomice au fost definite operațional..
Aceasta însemna că erau tratați ca și când ar fi fost fizică clasică; adică a fost măsurată o valoare inițială și valoarea finală a fost estimată în conformitate cu procedura prestabilită.
Aceasta presupunea definirea unui sistem de referință pentru măsurători, a instrumentului de măsurare și a modului de utilizare a instrumentului menționat, în conformitate cu metoda științifică..
În consecință, variabilele descrise de particulele subatomice trebuiau să se comporte într-un mod determinist. Adică, comportamentul său trebuia să fie prezis cu precizie și precizie..
Cu toate acestea, de fiecare dată când a fost efectuat un test de această natură, a fost imposibil să se obțină valoarea estimată teoretic în măsurare..
Măsurătorile au fost distorsionate din cauza condițiilor naturale ale experimentului, iar rezultatul obținut nu a fost util pentru a îmbogăți teoria atomică.
Exemplu
De exemplu: dacă este vorba de măsurarea vitezei și poziției unui electron, configurarea experimentului trebuie să aibă în vedere coliziunea unui foton de lumină cu electronul.
Această coliziune induce o variație a vitezei și a poziției intrinseci a electronului, cu care obiectul măsurării este modificat de condițiile experimentale..
Prin urmare, cercetătorul încurajează apariția unei erori experimentale inevitabile, în ciuda acurateței și preciziei instrumentelor utilizate..
Mecanica cuantică, alta decât mecanica clasică
În plus față de cele de mai sus, principiul nedeterminării lui Heisenberg afirmă că, prin definiție, mecanica cuantică funcționează diferit de mecanica clasică.
În consecință, se presupune că cunoașterea precisă a măsurătorilor la nivel subatomic este limitată de linia fină care separă mecanica clasică de cea cuantică..
Limitări ale modelului Heisenberg
În ciuda explicării indeterminării particulelor subatomice și a stabilirii diferențelor dintre mecanica clasică și cea cuantică, modelul atomic al lui Heisenberg nu stabilește o singură ecuație pentru a explica aleatorizarea acestui tip de fenomene..
Mai mult, faptul că relația este stabilită printr-o inegalitate implică faptul că gama de posibilități pentru produsul a două variabile canonice conjugate este nedeterminată. În consecință, incertitudinea inerentă proceselor subatomice este semnificativă..
Articole de interes
Modelul atomic al lui Schrödinger.
Modelul atomic de Broglie.
Modelul atomic Chadwick.
Modelul atomic al lui Perrin.
Modelul atomic al lui Thomson.
Model atomic Dalton.
Model atomic Dirac Jordan.
Model atomic al lui Democrit.
Modelul atomic al lui Leucipp.
Modelul atomic Bohr.
Modelul atomic Sommerfeld.
Modelul atomic actual.
Referințe
- Beyler, R. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Recuperat de pe: britannica.com
- Principiul incertitudinii Heisenberg (s.f.). Recuperat de la: hiru.eus
- García, J. (2012). Principiul incertitudinii lui Heisenberg. Recuperat de pe: hiberus.com
- Modele atomice (s.f.). Universitatea Națională Autonomă din Mexic. Mexic DF, Mexic. Recuperat de la: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.). Recuperat de pe: the-history-of-the-atom.wikispaces.com
- Wikipedia, Enciclopedia liberă (2018). Plank este constantă. Recuperat de pe: es.wikipedia.org
- Wikipedia, Enciclopedia liberă (2018). Relația de nedeterminare a lui Heisenberg. Recuperat de pe: es.wikipedia.org

Nimeni nu a comentat acest articol încă.