
Momentul dipol cum este calculat și exemple
moment dipol este o proprietate chimică care indică modul în care sunt distribuite în mod eterogen sarcinile electrice într-o moleculă. Este exprimat în unități Debye, 3,33 · 10-30 C · m și, în general, valorile sale variază de la 0 la 11 D.
Compușii foarte polari tind să aibă momente mari de dipol; în timp ce cele apolare, mici momente dipolare. Cu cât încărcăturile electrice sunt mai polarizate într-o moleculă, cu atât este mai mare momentul său dipolar; adică trebuie să existe o regiune bogată în electroni, δ-, și alta săracă în electroni, δ+.

Momentul dipolar, μ, este o magnitudine vectorială, deci este afectat de unghiurile legăturilor și, în general, de structura moleculară.
Când molecula este liniară, poate fi comparată cu o radieră în două culori. Finalul său negativ δ-, ar corespunde culorii roșii; în timp ce pozitivul, δ +, ar fi culoarea albastră. Pe măsură ce mărimile sarcinilor negative la polul δ cresc și distanța care îl separă de δ +, momentul dipolar crește.
Din punct de vedere chimic, acest lucru înseamnă că, cu cât diferența de electronegativitate între doi atomi este mai mare și cu cât este mai mare distanța care le separă, cu atât este mai mare momentul dipolar dintre ele..
Indice articol
- 1 Cum se calculează momentul dipolar?
- 2 Exemple
- 2.1 Apă
- 2.2 Metanol
- 2.3 Amoniac
- 2.4 Etanol
- 2.5 Dioxid de carbon
- 2.6 Metan
- 3 Referințe
Cum calculați momentul dipol?
Se consideră o legătură covalentă între doi atomi, A și B:
A-B
Distanța dintre sarcinile parțiale pozitive și negative este deja definită de lungimea obligațiunii lor:
LAδ+-Bδ-
Deoarece protonii și electronii au aceeași magnitudine a sarcinii electrice, dar cu semne opuse, 1,6 · 10-19C, acesta este cel luat în considerare la evaluarea momentului dipolar între A și B folosind următoarea ecuație:
μ = δd
Unde μ este momentul dipol, δ este sarcina electronului fără semn negativ și d lungimea legăturii exprimată în metri. De exemplu, presupunând că d are o valoare de 2 Å (1 10-10m) momentul dipolar, μA-B va fi:
μA-B = (1,6 10-19C) · (2 · 10-10m)
= 3,210-29Cm
Dar, deoarece această valoare este foarte mică, se utilizează unitatea Debye:
μ = (3.210-29C · m) · (1 D / 3,33 · 10-30 Cm)
= 9,60 D
Această valoare a μA-B ar putea presupune că legătura A-B este mai ionică decât covalentă.
Exemple
Apă
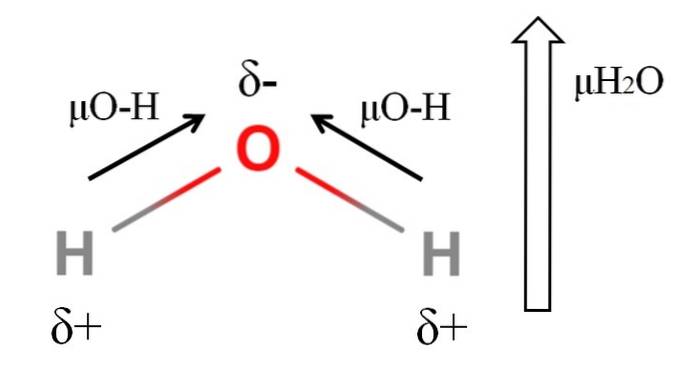
Pentru a calcula momentul dipol al unei molecule, toate momentele dipolare ale legăturilor lor respective trebuie adăugate vectorial, având în vedere unghiurile de legătură și un pic de trigonometrie. Asta la început.
Apa are unul dintre cele mai mari momente dipolice care ar putea fi de așteptat pentru un compus covalent. În imaginea de sus avem că atomii de hidrogen au sarcini parțiale pozitive, δ +, în timp ce oxigenul are o sarcină parțială negativă, δ-. Legătura O-H este destul de polară (1,5D) și există două dintre ele într-o moleculă HDouăSAU.
De obicei se desenează un vector care este direcționat de la cel mai puțin electronegativ atom (H) la cel mai electronegativ (O). Deși nu sunt trase, pe atomul de oxigen există două perechi de electroni nepartajați, care „concentrează” în continuare regiunea negativă..
Datorită geometriei unghiulare a HDouăSau, momentele dipolice se adaugă în direcția atomului de oxigen. Rețineți că suma celor doi μO-H ar da 3D (1,5 + 1,5); dar nu este așa. Momentul dipolar al apei are o valoare experimentală de 1,85D. Efectul unghiului de aproape 105º dintre legăturile H-O-H este prezentat aici..
Metanol
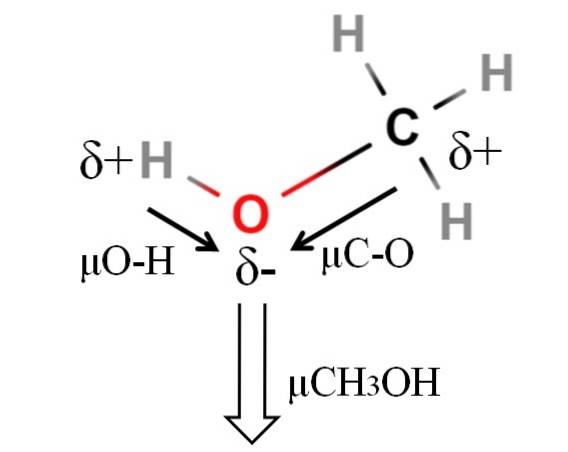
Momentul dipolar al metanolului este 1,69D. Este mai puțin decât cea a apei. Prin urmare, masele atomice nu au prea multă influență asupra momentului dipolar; dar razele lor atomice sunt. În cazul metanolului, nu putem afirma că legătura sa H-O are un μ egal cu 1,5D; întrucât mediile moleculare sunt diferite în CH3OH și HDouăSAU.
De aceea, lungimea legăturii H-O în metanol ar trebui măsurată pentru a calcula μO-H. Ceea ce se poate spune este că μO-H este mai mare decât μC-O, deoarece diferența de electronegativitate între carbon și oxigen este mai mică decât între hidrogen și oxigen..
Metanolul este listat ca unul dintre cei mai polari solvenți care pot fi găsiți împreună cu apă și amoniac..
Amoniac
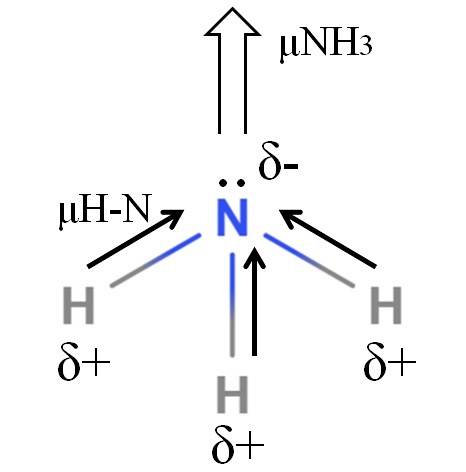
Legăturile H-N sunt destul de polare, astfel încât azotul, datorită electronegativității sale mai mari, atrage electroni spre sine (imaginea superioară). În plus, pe acesta avem o pereche de electroni nepartajată, care contribuie la încărcările lor negative în regiunea δ-. Prin urmare, sarcinile electrice predomină pe atomul de azot al amoniacului..
Amoniacul are un moment dipolar de 1,42D, mai mic decât cel al metanolului. Dacă atât amoniacul, cât și metanolul ar putea fi transformate în curenți de aer, s-ar vedea că tirajul de metanol are poli mai definiți în comparație cu tirajul de amoniac.
Etanol
În cazul etanolului, CH3CHDouăOH, momentul său dipolar este foarte apropiat de cel al metanolului, dar tinde să aibă valori mai mici. Deoarece există mai mulți atomi de carbon care alcătuiesc regiunea δ +, atomul de oxigen care reprezintă δ- începe să piardă puțin din „intensitatea sa relativă negativă”.
Dioxid de carbon
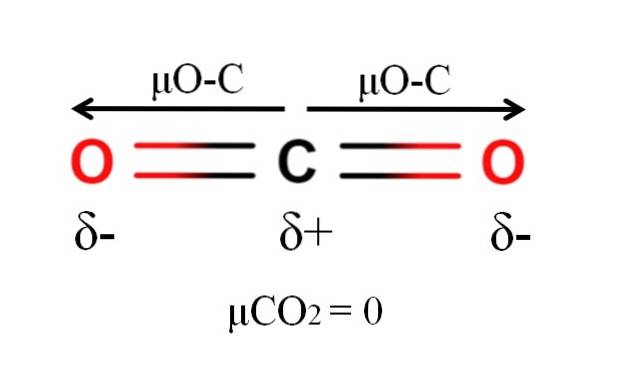
Dioxidul de carbon are două legături polare, C = O, cu momentele dipolare respective μO-C. Cu toate acestea, după cum se poate vedea în imaginea de mai sus, geometria liniară a CODouă determină anularea reciprocă a celor doi μO-C, chiar și atunci când carbonul are o sarcină parțială pozitivă și oxigenii au sarcini parțiale negative.
Din acest motiv, dioxidul de carbon este o moleculă apolară, deoarece μCODouă are o valoare de 0D.
Metan
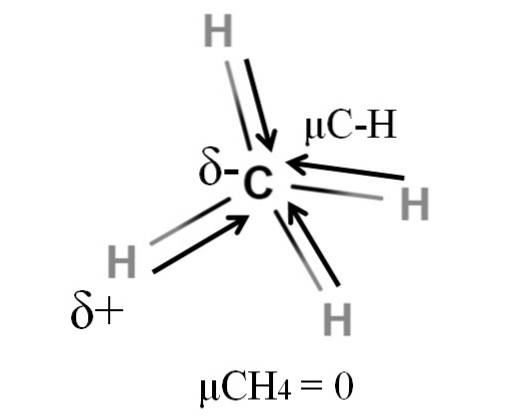
Atât metanul, cât și dioxidul de carbon împărtășesc ceva în comun: sunt molecule foarte simetrice. În general, cu cât o moleculă este mai simetrică, cu atât este mai mic momentul său dipolar..
Dacă vedem molecula CH4, legăturile sale C-H sunt polare, iar electronii sunt direcționați către atomul de carbon, deoarece este puțin mai electronegativ. S-ar putea crede că carbonul ar trebui să fie o regiune highly- extrem de negativă; ca o radieră cu centrul roșu intens și capetele albăstrui.
Cu toate acestea, prin divizarea CH4 în jumătate am obține două jumătăți H-C-H, una în stânga și cealaltă în dreapta, asemănătoare cu molecula HDouăO. Astfel, momentul dipolar rezultat din adăugarea acestor doi μC-H s-ar anula cu cel din cealaltă jumătate. Și, prin urmare, μCH4 are o valoare de 0D.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Walter J. Moore. (1963). Chimie Fizica. În cinetica chimică. Ediția a patra, Longmans.
- Ira N. Levine. (2009). Principiile fizico-chimiei. Ediția a șasea, pp. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, dr. (29 ianuarie 2020). Definiția momentului dipol. Recuperat de pe: thoughtco.com
- Blaber Mike. (29 septembrie 2019). Momente Dipol. Chimie LibreTexte. Recuperat de pe: chem.libretexts.org
- LaRita Williams. (2020). Momentul dipol: definiție, ecuație și exemple. Studiu. Recuperat de la: study.com
- Wikipedia. (2020). Moment dipol bond. Recuperat de pe: en.wikipedia.org



Nimeni nu a comentat acest articol încă.