
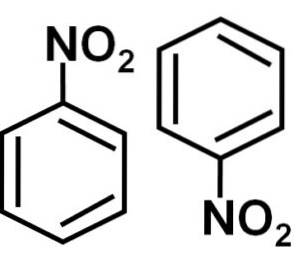
Structura nitrobenzenului (C6H5NO2), proprietăți, utilizări, riscuri
nitrobenzen este un compus organic aromatic format dintr-un inel benzenic C6H5- și o grupare nitro-NODouă. Formula sa chimică este C6H5NUDouă. Este un lichid uleios incolor sau galben pal, care miroase a migdale amare sau lac de pantofi..
Nitrobenzenul este un compus foarte util în industria chimică, deoarece face posibilă obținerea unei serii de substanțe chimice care au diverse utilizări. Acest lucru se datorează faptului că poate fi supus la diferite tipuri de reacții.
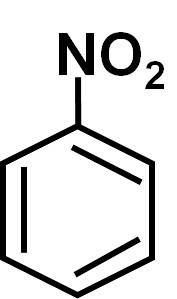
Reacțiile chimice importante includ nitrația (care permite adăugarea mai multor grupe -NODouă la moleculă) și reducere (opusul oxidării deoarece sunt eliminați cei doi atomi de oxigen din grupa nitro-NODouă și sunt înlocuiți cu hidrogeni).
Cu nitrobenzen, de exemplu, se pot prepara anilină și para-acetaminofenol. Acesta din urmă este binecunoscutul acetaminofen care este un antipiretic (medicament împotriva febrei) și ușor analgezic (medicament împotriva durerii minore)..
Nitrobenzenul trebuie tratat cu prudență, deoarece este iritant și toxic, poate provoca un tip de anemie, printre mai multe simptome, și se crede că provoacă cancer. De asemenea, dăunează mediului.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Punct de aprindere
- 3.6 Temperatura de autoinflamare
- 3.7 Densitate
- 3.8 Solubilitate
- 3.9 Proprietăți chimice
- 3.10 Formarea dimerului
- 3.11 Alte proprietăți
- 4 Obținerea
- 5 utilizări
- 5.1 În obținerea anilinei și acetaminofenului
- 5.2 În obținerea altor compuși chimici
- 5.3 În diverse aplicații
- 6 Riscuri
- 7 Tratamente pentru eliminarea sa din mediu
- 8 Referințe
Structura
Nitrobenzen C6H5-NUDouă este o moleculă plană formată dintr-un inel benzenic C6H5- de care este atașată o grupare nitro -NODouă. Molecula sa este plană, deoarece există o interacțiune electronică între grupul nitro-NODouă iar inelul benzenic.
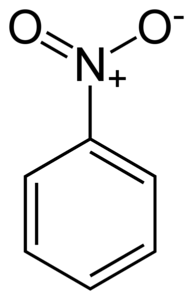
Grupul nitro -NODouă tinde să atragă electroni din inelul benzenic C6H5-.
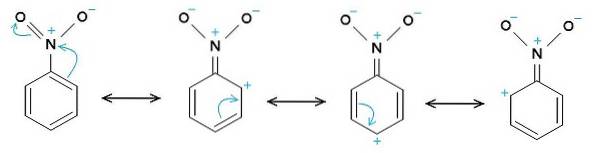
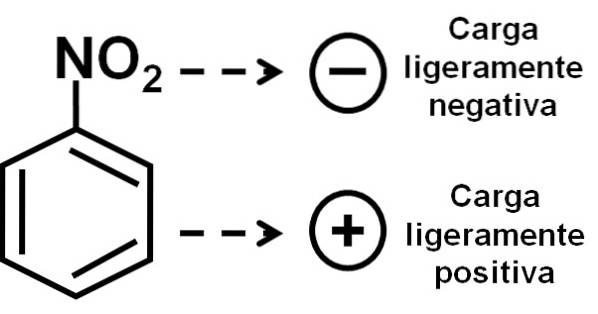
Prin urmare, molecula are o latură puțin mai negativă (unde oxigenii de -NODouă) și o parte puțin mai pozitivă (inelul benzenic).
Nomenclatură
- Nitrobenzen.
- Nitrobenzină.
- Nitrobenzol.
- Ulei sau esență Myrban sau Myrban (termen dezafectat).
Proprietăți
Starea fizică
Lichid uleios incolor până la galben pal.
Greutate moleculară
123,11 g / mol.
Punct de topire
5,7 ºC.
Punct de fierbere
211 ºC.
Punct de aprindere
88 ºC (metoda cupei închise).
temperatură de autoaprindere
480 ° C.
Densitate
1,2037 g / cm3 la 20 ° C.
Solubilitate
Ușor solubil în apă: 0,19 g / 100 g apă la 20 ° C. Complet miscibil cu alcool, benzen și dietil eter.
Proprietăți chimice
Nitrobenzenul este stabil până la temperatura de aproximativ 450 ° C la care începe să se descompună formând (în absența oxigenului) NU, NUDouă, benzen, bifenil, anilină, dibenzofuran și naftalină.
Reacțiile importante de nitrobenzen includ reducerea, nitrarea, halogenarea și sulfonarea..
Nitrarea nitrobenzenului produce inițial metan-nitrobenzen și cu un timp de reacție prelungit se obține 1,3,5-nitrobenzen.
Prin reacția bromului sau clorului cu nitrobenzen în prezența unui catalizator adecvat, se obține 3-bromo-nitrobenzen (meta-bromonitrobenzen) sau 3-clor-nitrobenzen (meta-cloronitrobenzen)..
Un exemplu de reducere este că atunci când se tratează cu staniu (Sn) în acid clorhidric (HCI) meta-halogenonitrobenzenii sunt obținuți meta-halogenoaniline.
Sulfonarea cu nitrobenzen se efectuează cu acid sulfuric fumigant la 70-80 ° C și produsul este acidul meta-nitrobenzensulfonic. Acest lucru poate fi redus cu fier și HCI pentru a da acid metanilic..
Formarea dimerului
Într-o soluție de benzen C6H6 moleculele de nitrobenzen se asociază între ele pentru a forma dimeri sau perechi de molecule. În aceste perechi, una dintre molecule se află într-o poziție inversată față de cealaltă..
Formarea dimerilor de nitrobenzen cu molecule una într-o poziție inversă față de cealaltă se datorează, probabil, fiecăruia dintre ei având o parte ușor mai încărcată pozitiv și o parte opusă cu o încărcare puțin mai negativă..
În dimer, partea cu o sarcină puțin mai pozitivă a uneia dintre molecule este posibil situată aproape de sarcina ușor negativă a celeilalte molecule, deoarece sarcinile opuse se atrag reciproc și acesta este cazul celorlalte două părți..
Alte proprietăți
Are un miros similar cu migdalele sau lustruirea pantofilor. La scăderea temperaturii sale se solidifică sub formă de cristale de culoare galben verzuie.
Obținerea
Se obține prin tratarea benzenului C6H6 cu un amestec de acid azotic HNO3 și acid sulfuric HDouăSW4. Procesul se numește nitrare și implică formarea ionului nitronium NODouă+ datorită prezenței acidului sulfuric HDouăSW4.
- Ion nitroniu NO formareDouă+:
HNO3 + 2 oreDouăSW4 ⇔ H3SAU+ + 2 HSO4- + NUDouă+ (ion nitroniu)
- Ionul de nitroni atacă benzenul:
C6H6 + NUDouă+ → C6H6NUDouă+
- Nitrobenzenul se formează:
C6H6NUDouă+ + HSO4- → C6H5NUDouă + HDouăSW4
În concluzie:
C6H6 + HNO3 → C6H5NUDouă + HDouăSAU
Reacția de nitrare a benzenului este foarte exotermă, adică se generează multă căldură, deci este foarte periculoasă.
Aplicații
În obținerea anilinei și acetaminofenului
Nitrobenzenul este utilizat în principal pentru sintetizarea anilinei C6H5NHDouă, care este un compus utilizat pe scară largă pentru prepararea pesticidelor, gingiilor, coloranților, explozivilor și medicamentelor.
Obținerea anilinei are loc prin reducerea nitrobenzenului într-un mediu acid în prezența fierului sau a staniului, care se efectuează conform următoarelor etape:
Nitrobenzen → Nitrosobenzen → Fenilhidroxilamină → Anilină
C6H5NUDouă → C6H5NU → C6H5NHOH → C6H5NHDouă

În funcție de condiții, procesul poate fi oprit într-una din etapele intermediare, de exemplu fenilhidroxilamină. Pornind de la fenilhidroxilamină într-un mediu puternic acid, para-aminofenolul poate fi preparat:
Fenilhidroxilamină → p-Aminofenol
C6H5NHOH → HOC6H4NHDouă
Acesta din urmă este tratat cu anhidridă acetică pentru a obține paracetamol (acetaminofen), un antipiretic cunoscut și analgezic ușor, adică un medicament pentru tratarea febrei și a durerii..
O altă modalitate de a obține anilină este prin reducerea nitrobenzenului cu monoxid de carbon (CO) într-un mediu apos în prezența unor particule foarte mici (nanoparticule) de paladiu (Pd) ca catalizator..
C6H5-NUDouă + 3 CO + HDouăO → C6H5-NHDouă + 3 CODouă
În obținerea altor compuși chimici
Nitrobenzenul este punctul de plecare pentru a obține o mare varietate de compuși folosiți ca coloranți, pesticide, medicamente și produse cosmetice.

De exemplu, face posibilă obținerea 1,3-dinitrobenzenului, care prin clorare (adăugare de clor) și reducere (eliminarea atomilor de oxigen) generează 3-cloranilină. Acesta este utilizat ca intermediar pentru pesticide, coloranți și medicamente.
Nitrobenzenul a fost folosit pentru a prepara benzidina care este un colorant. În plus, nitrobenzenul este utilizat pentru a prepara chinolină, azobenzen, acid metanilic, dinitrobenzen, izocianați sau piroxilină printre mulți alți compuși..
În diverse aplicații
Nitrobenzenul este utilizat sau a fost folosit ca:
- Solvent de extracție pentru purificarea uleiurilor lubrifiante utilizate în mașini
- Solvent pentru eteri de celuloză
- Ingredient amestec de lustruire a metalelor
- În săpunuri
- În amestecurile de lustruit pantofi
- Conservant pentru vopsea spray
- Componenta amestecurilor de lustruire a pardoselii
- Înlocuitor al esenței de migdale
- În industria parfumurilor
- În producția de cauciuc sintetic
- Solvent în diferite procese

Riscuri
Nitrobenzenul este toxic prin inhalare, ingestie și absorbție prin piele..
Iritant pentru piele, ochi și căile respiratorii. Poate provoca un tip de anemie numită methemoglobinemie, care implică o reducere a capacității celulelor roșii din sânge de a elibera oxigen în țesuturi și duce la oboseală..
În plus, nitrobenzenul provoacă dispnee, amețeli, tulburări de vedere, dificultăți de respirație, colaps și moarte. De asemenea, dăunează ficatului, splinei, rinichilor și sistemului nervos central.
Se estimează că poate fi un mutagen și posibil cauza cancerului la om, deoarece a provocat-o la animale.
În plus, nitrobenzenul nu trebuie eliminat în mediu. Toxicitatea sa față de animale, plante și microorganisme o face foarte dăunătoare ecosistemelor.
Toxicitatea față de microorganisme reduce biodegradabilitatea acestora.
Tratamente pentru eliminarea sa din mediu
Contaminarea mediului cu nitrobenzen poate apărea prin deșeurile din diferitele industrii care îl utilizează, cum ar fi industria coloranților sau a explozivilor..
Nitrobenzenul este un poluant extrem de toxic și greu de descompus în condiții naturale, din acest motiv poate provoca o contaminare severă a apei potabile și a sistemelor de irigare a culturilor..
Datorită stabilității și toxicității ridicate față de microorganisme, este adesea selectat ca model în studiile de tratare a apelor uzate..
Sunt cercetate diferite modalități de a elimina nitrobenzenul din apa contaminată. Una dintre ele este prin degradarea fotocatalitică, adică folosind lumina soarelui ca accelerator al reacției de degradare în prezența dioxidului de titan TiODouă.

Metodele de microelectroliză cu un catalizator de fier (Fe) și cupru (Cu) în ceramică au fost de asemenea testate cu succes. Microelectroliza permite ca nitrobenzenul să fie descompus de un curent electric.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Nitrobenzen. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Morrison, R.T. și Boyd, R.N. (2002). Chimie organica. Ediția a 6-a. Prentice-Hall.
- Moldoveanu, S.C. (2019). Piroliza altor compuși care conțin azot. În Piroliza Moleculelor Organice (Ediția a II-a). Recuperat de la sciencedirect.com.
- Smith, P.W.G. și colab. (1969). Nitrare aromatică-compuși nitro. Substituții electrofile. În chimia aromatică. Recuperat de la sciencedirect.com.
- Windholz, M. și colab. (editori) (1983). Indicele Merck. O enciclopedie a substanțelor chimice, a medicamentelor și a produselor biologice. Ediția a X-a. Merck & CO., Inc.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. Volumul A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. și colab. (2012). Degradarea fotocatalitică iradiată UV de nitrobenzen prin legarea Titania pe tubul de cuarț. International Journal of Photoenergy, Volumul 2012, ID articol 681941. Recuperat de pe hindawi.com.
- Shikata, T. și colab. (2014). Formarea dimerului antiparalel nitrobenzenic în solvenți nepolari. AIP Advances 4, 067130 (2014). Recuperat de pe doaj.org.
- Krogul-Sobczak, A. și colab. (2019). Reducerea nitrobenzenului la anilină cu CO / HDouăO în prezența nanoparticulelor de paladiu. Catalizatori 2019, 9, 404. Recuperat de pe mdpi.com.
- Yang, B. și colab. (2019). Producția la scară pilot, proprietățile și aplicarea umpluturii catalitice-ceramice Fe / Cu pentru tratarea apelor uzate cu compuși nitrobenzenici. Catalizatori 2019, 9, 11. Recuperat de pe mdpi.com.

Nimeni nu a comentat acest articol încă.