
Numărul masei din ce constă și cum se obține (cu exemple)

numar de masa Numărul de masă al unui atom este suma numărului de protoni și a numărului de neutroni din nucleu. Aceste particule sunt desemnate interschimbabil prin numele de nucleoni, de aceea numărul masei reprezintă cantitatea acestora.
Fie N numărul de neutroni prezenți și Z numărul de protoni, dacă numim A ca număr de masă, atunci:
A = N + Z
Indice articol
- 1 Exemple de numere de masă
- 1.1 Hidrogen
- 1.2 Oxigen
- 1.3 Carbon
- 1.4 Uraniu
- 2 Cum se obține numărul de masă?
- 2.1 Notare pentru atomi
- 3 izotopi
- 3.1 Izotopii carbonului
- 4 Exemple lucrate
- 4.1 - Exemplul 1
- 4.2 - Exemplul 2
- 5 Referințe
Exemple de numere de masă
Iată câteva exemple de numere de masă pentru elemente bine cunoscute:
Hidrogen
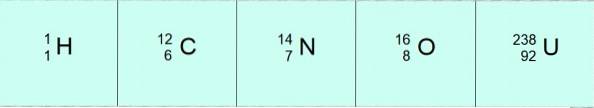
Cel mai stabil și mai abundent atom de hidrogen este, de asemenea, cel mai simplu: 1 proton și un electron. Deoarece nucleul de hidrogen nu are neutroni, este adevărat că A = Z = 1.
Oxigen
Un nucleu de oxigen are 8 neutroni și 8 protoni, deci A = 16.
Carbon
Viața pe Pământ se bazează pe chimia carbonului, un atom ușor cu 6 protoni în nucleul său plus 6 neutroni, deci A = 6 + 6 = 12.
Uraniu
Acest element, mult mai greu decât precedentele, este bine cunoscut pentru proprietățile sale radioactive. Nucleul de uraniu are 92 de protoni și 146 de neutroni. Atunci numărul său de masă este A = 92 + 146 = 238.
Cum se obține numărul de masă?
Așa cum am menționat anterior, numărul de masă A al unui element corespunde întotdeauna cu suma numărului de protoni și a numărului de neutroni pe care îi conține nucleul. Este, de asemenea, un număr întreg, dar ... există vreo regulă cu privire la relația dintre cele două cantități??
Să vedem: toate elementele menționate mai sus sunt ușoare, cu excepția uraniului. Atomul de hidrogen este, după cum am spus, cel mai simplu. Nu are neutroni, cel puțin în versiunea sa cea mai abundentă, iar în oxigen și carbon, există un număr egal de protoni și neutroni.
Se întâmplă și cu alte elemente ușoare, cum ar fi azotul, un alt gaz foarte important pentru viață, care are 7 protoni și 7 neutroni. Cu toate acestea, pe măsură ce nucleul devine mai complex și atomii devin mai grei, numărul de neutroni crește cu o rată diferită..
Spre deosebire de elementele ușoare, uraniul, cu 92 de protoni, are aproximativ 1 ½ ori cantitatea în neutroni: 1 ½ x 92 = 1,5 x 92 = 138.
După cum puteți vedea, este destul de aproape de 146, cantitatea de neutroni pe care o are.
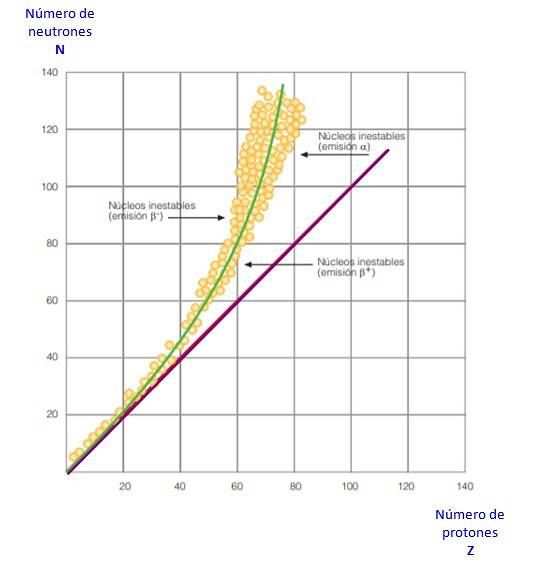
Toate acestea sunt evidente în curba din figura 2. Este un grafic al lui N versus Z, cunoscut sub numele de curba stabilității nucleare. Acolo puteți vedea cum atomii de lumină au același număr de protoni ca și neutroni și cum de la Z = 20 crește numărul de neutroni..
În acest fel, atomul mare devine mai stabil, deoarece excesul de neutroni reduce repulsia electrostatică dintre protoni..
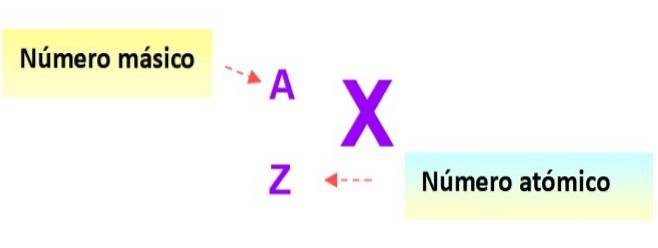
Notare pentru atomi
O notație foarte utilă care descrie rapid tipul de atom este următoarea: simbolul elementului și numerele atomice și de masă respective sunt scrise așa cum se arată mai jos în această diagramă:
În această notație, atomii din exemplele anterioare ar fi:
Uneori se folosește o altă notație mai confortabilă, în care doar simbolul elementului și numărul de masă sunt utilizate pentru a desemna atomul, omițând numărul atomic. În acest fel, 12 6C este scris pur și simplu ca carbon-12, 16 8Sau ar fi oxigen-16 și așa mai departe pentru orice element.
Izotopi
Numărul de protoni dintr-un nucleu determină natura elementului. De exemplu, fiecare atom al cărui nucleu conține 29 de protoni este un atom de cupru, indiferent de ce..
Să presupunem că un atom de cupru pierde un electron din orice motiv, este tot cupru. Cu toate acestea, acum este un atom ionizat.
Este mai dificil pentru un nucleu atomic să câștige sau să piardă un proton, dar în natură poate apărea. De exemplu, în interiorul stelelor, elemente mai grele sunt formate continuu din elemente ușoare, deoarece nucleul stelar se comportă ca un reactor de fuziune..
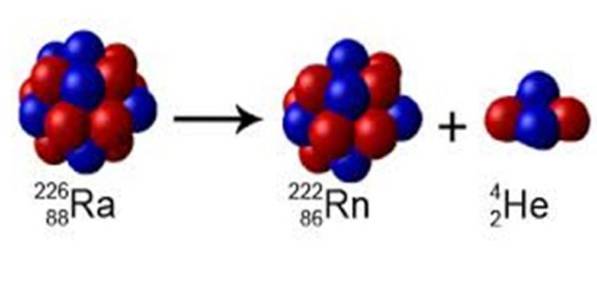
Și chiar aici pe Pământ există fenomenul dezintegrarea radioactivă, în care unii atomi instabili expulzează nucleoni și emit energie, transformându-se în alte elemente.
În cele din urmă, există posibilitatea ca un atom al unui anumit element să aibă un număr de masă diferit, în acest caz este un izotop.
Un bun exemplu este binecunoscutul carbon-14 sau radiocarbon, care este folosit pentru datarea obiectelor arheologice și ca trasor biochimic. Este același carbon, cu proprietăți chimice identice, dar cu doi neutroni în plus.
Carbon-14 este mai puțin abundent decât carbon-12, izotopul stabil și este, de asemenea, radioactiv. Aceasta înseamnă că în timp se descompune emițând energie și particule până devine un element stabil, care în cazul său este azot..
Izotopi de carbon
Carbonul există în natură ca un amestec de mai mulți izotopi, dintre care cel mai abundent este deja menționat 12 6C sau carbon-12. Și pe lângă carbonul 14 există 13 6C cu un neutron suplimentar.
Acest lucru este comun în natură, de exemplu, 10 izotopi stabili sunt cunoscuți de staniu. Pe de altă parte, despre beriliu și sodiu, se cunoaște doar un singur izotop.
Fiecare izotop, natural sau artificial, are o rată diferită de transformare. În același mod, este posibil să se creeze izotopi artificiali în laborator, care sunt în general instabili și se dezintegră radioactiv într-o perioadă foarte scurtă de fracțiuni de secundă, în timp ce altele durează mult mai mult, atâta timp cât vârsta Pământului sau mai mult ..
Tabelul izotopilor naturali ai carbonului
| Izotopi de carbon | Numărul atomic Z | Masa numărul A | Abundenţă% |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98,89 |
| 13 6 C | 6 | 13 | 1.11 |
| 14 6 C | 6 | 14 | Urme |
Exemple lucrate
- Exemplul 1
Care e diferenta dintre 13 7 N și 14 7 N?
Răspuns
Ambii sunt atomi de azot, deoarece numărul lor atomic este 7. Cu toate acestea, unul dintre izotopi, cel cu A = 13, are un neutron mai puțin, în timp ce 14 7 N este cel mai abundent izotop.
- Exemplul 2
Câți neutroni sunt în nucleul unui atom de mercur, notat ca 201 80 Hg?
Răspuns
Din moment ce A = 201 și Z = 80, și, de asemenea, știind că:
A = Z + N
N = A - Z = 201 - 80 = 121
Și se concluzionează că atomul de mercur are 121 de neutroni.
Referințe
- Connor, N. Ce este nucleul - Structura nucleului atomic - Definiție. Recuperat de pe: periodic-table.org.
- Knight, R. 2017. Fizica pentru oamenii de știință și inginerie: o abordare strategică. Pearson.
- Sears, Zemansky. 2016. Fizică universitară cu fizică modernă. 14. Ed. Volumul 2.
- Tippens, P. 2011. Fizică: concepte și aplicații. Ediția a VII-a. Dealul Mcgraw.
- Wikipedia. Numar de masa. Recuperat de pe: en.wikipedia.org.



Nimeni nu a comentat acest articol încă.