
Proprietăți de permanganat de sodiu (NaMnO4), riscuri
permanganat de sodiu Este un compus chimic cu formula NaMnO4. Este disponibil în principal sub formă monohidrat. Structura sa este prezentată în figura 1. Această sare este higroscopică și are un punct de topire scăzut..
Are aceleași proprietăți ca permanganatul de potasiu (KMnO4), deși permanganatul de sodiu este de aproximativ 15 ori mai solubil în apă. În ciuda acestui fapt, permanganatul de potasiu este mai frecvent utilizat deoarece costurile sale de producție sunt mai mici..
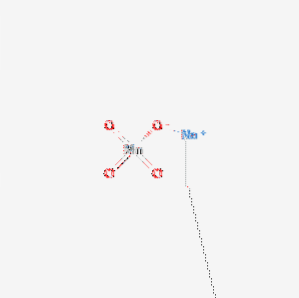
Permanganatul de sodiu se dizolvă cu ușurință în apă pentru a da soluții violet intens, a căror evaporare conferă cristale prismatice violet-negru strălucitor de NaMnO4 · H2O monohidrat. Sarea de potasiu nu formează un hidrat. Datorită naturii sale higroscopice, este mai puțin util în chimia analitică decât omologul său de potasiu..
Poate fi preparat prin reacția dioxidului de mangan cu hipoclorit de sodiu și hidroxid de sodiu sau carbonat de sodiu după cum urmează:
2MnODouă + 3NaClO + 2NaOH → 2NaMnO4 + 3NaCl + HDouăSAU
2MnODouă + 3NaClO + NaDouăCO3 → 2NaMnO4 + 3NaCl + CODouă
Folosind carbonat de sodiu, randamentul este mai mic și reacția trebuie încălzită pentru a obține produsul (vapid, 2016).
Indice articol
- 1 Proprietăți fizice și chimice
- 2 Reactivitate și pericole
- 3 utilizări
- 4 Referințe
Proprietati fizice si chimice
Permanganatul de sodiu are un aspect similar cu permanganatul de potasiu. Sunt cristale prismatice sau sfere violete care în soluție apoasă formează un lichid colorat care variază de la roz la violet în funcție de concentrație. Aspectul său este prezentat în figura 2.

Forma anhidră a compusului are o greutate moleculară și un punct de topire de 141,9254 g / mol și respectiv 36 ° C, iar forma monohidrat are o greutate moleculară și un punct de topire de 159,94 g / mol și respectiv 170 ° C.
Densitatea sa este de 1.972 g / ml și este foarte solubilă în apă, putând dizolva 900g pe litru la temperatura camerei (National Center for Biotechnology Information, 2017).
Reactivitate și pericole
Permanganatul de sodiu nu este combustibil, dar accelerează arderea materialelor combustibile. Dacă materialul combustibil este divizat fin, amestecul poate fi exploziv..
Se poate aprinde spontan în contact cu materiale combustibile lichide. Contactul cu acid sulfuric poate provoca incendii sau explozii..
Acidul acetic sau anhidrida acetică pot exploda cu permanganate dacă nu sunt păstrate la rece. Exploziile pot apărea atunci când permanganatele care au fost tratate cu acid sulfuric intră în contact cu benzen, disulfură de carbon, dietil eter, alcool etilic, petrol sau materie organică (SODIUM PERMANGANATE, 2016).
Aceste substanțe accelerează arderea atunci când sunt implicate într-un incendiu. Unii se pot descompune exploziv atunci când sunt încălziți sau implicați într-un incendiu. Poate exploda de căldură sau contaminare.
Unii vor reacționa exploziv cu hidrocarburi (combustibili). Poate aprinde combustibili (lemn, hârtie, ulei, îmbrăcăminte etc.). Recipientele pot exploda la încălzire. Scurgerea poate crea un pericol de incendiu sau explozie (SODIUM PERMANGANATE, S.F.).
Permanganatul de potasiu reacționează cu apa pentru a produce dioxid de mangan, hidroxid de potasiu și oxigen. Hidroxidul de potasiu este un puternic coroziv. În cazurile severe, pot apărea efecte sistemice, inclusiv coagulare intravasculară, hepatită, pancreatită și eșec..
Ingerarea cronică poate provoca parestezii, tremurături din cauza toxicității manganului. Neurotoxicitatea la mangan este rezultatul epuizării dopaminei și neurotoxinelor, a chinonei dopaminei și a peroxidului (SODIUM PERMANGANATE, 2014).
Permanganatul de sodiu dăunează țesutului ocular la contact, provocând arsuri. Poate fi iritant la contactul cu pielea, lăsând pete violete pe ea. În caz de inhalare, poate provoca leziuni ale căilor respiratorii (fișa de date cu date materiale permanganat de sodiu, S.F.).
Dacă compusul intră în contact cu pielea, trebuie clătit cu multă apă timp de cel puțin 15 minute în timp ce îndepărtați îmbrăcămintea și încălțămintea contaminate..
În caz de înghițire, vărsăturile nu trebuie induse. Îmbrăcămintea strânsă, cum ar fi gulerul cămășii, cureaua sau cravata ar trebui să fie slăbită. Dacă victima nu respiră, trebuie administrată resuscitarea gură la gură..
În caz de inhalare, victima trebuie scoasă din locul de expunere și mutată într-un loc răcoros. Dacă nu respiră, trebuie administrată respirație artificială. Dacă respirația este dificilă, trebuie administrat oxigen.
În toate cazurile, trebuie acordată asistență medicală imediată (Fișa tehnică de securitate a materialului Permanganat de sodiu monohidrat, 2013).
Aplicații
Permanganatul de sodiu, ca și compusul de potasiu, este un dezinfectant și un antiseptic bactericid. Utilizările sale includ rășini de albire, ceruri, grăsimi, paie, bumbac, mătase și alte fibre și piele de căprioară.
Este, de asemenea, utilizat ca dezinfectant, deodorant, dezinfectant chimic în fotografie și reactiv în chimia organică sintetică..
Utilizările ilicite au inclus producția de droguri de abuz și avort prin aplicare topică pe peretele vaginal. Din punct de vedere istoric, soluțiile de permanganat au fost utilizate ca irigant uretral și fluid de spălare pentru otrăvire..
Permanganatul de sodiu acționează ca un agent oxidant în oxidarea o-toluen sulfonamidei pentru a produce zaharină și purificarea toluenei amide. Este, de asemenea, un antidot la morfină și fosfor și la reacțiile sintetice organice / farmaceutice..
Permanganatul de sodiu a fost utilizat în tratarea apei și reabilitarea solului, deoarece este capabil să degradeze BTEX (benzen, toluen, etilbenzen și xilen), fenoli, hidrocarburi aromatice policiclice (HAP), eteni și explozivi clorurați și să îndepărteze hidrogenul sulfurat.
Datorită solubilității ridicate în apă, permanganatul de sodiu este preferat pentru aplicații care necesită concentrații mari de ioni permanganat, cum ar fi gravarea pieselor din plastic ale plăcii de circuite imprimate..
Alte utilizări ale permanganatului de sodiu includ agentul de tratare a suprafețelor metalice și formularea de curățare a metalelor etc. (Soluție apoasă de permanganat de sodiu (NaMnO4), S.F.).
Permanganatul de sodiu poate substitui permanganatul de potasiu în unele aplicații, deoarece ionul permanganat este agentul oxidant..
Cu toate acestea, deoarece permanganatul de sodiu există sub formă monohidrat, acesta nu poate fi utilizat pentru aplicații analitice, cum ar fi titrările redox..
Referințe
- Fișă tehnică de securitate permanganat de sodiu. (S.F.). Adus de la dogee.org: dogee.org.
- Fișă tehnică de securitate Permanganat de sodiu monohidrat. (2013, 21 mai). Adus de la sciencelab: sciencelab.com.
- Centrul Național pentru Informații despre Biotehnologie. (2017, 4 martie). Baza de date compusă PubChem; CID = 23673458. Adus de la PubChem: pubchem.ncbi.nlm.nih.gov.
- PERMANGANAT DE SODIU. (2014, 5 decembrie). Adus de la toxnet: toxnet.nlm.nih.gov.
- PERMANGANAT DE SODIU. (2016). Adus de la cameochemicals: cameochemicals.noaa.gov.
- Soluție apoasă de permanganat de sodiu (NaMnO4). (S.F.). Adus de la changyuancorp: en.changyuancorp.com.
- PERMANGANAT DE SODIU. (S.F.). Adus din chemicalbook: chemicalbook.com.
- (2016, 27 iunie). Permanganat de sodiu din dioxid de mangan și hipoclorit de sodiu. Adus de la chemistry.stackexchange: chemistry.stackexchange.com.

Nimeni nu a comentat acest articol încă.