
Structura peroxidului de hidrogen (H2O2), proprietăți, utilizări, producție
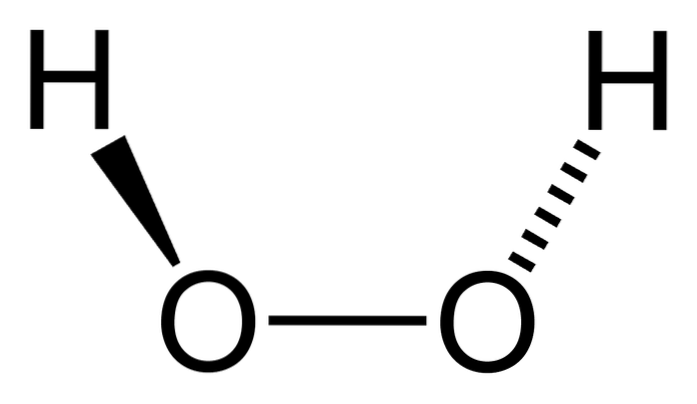
apă oxigenată este un compus anorganic a cărui formulă chimică este HDouăSAUDouă. Dintre toate, este cel mai simplu peroxid din această familie de compuși chimici. Formula sa structurală este H-O-O-H, fiind această punte oxigenată internă caracteristică tuturor peroxizilor.
În 1818, HDouăSAUDouă Acesta a fost identificat de Louies Jacques Thénard, care a pregătit un compus chimic pe care la acea vreme îl numea peroxid de hidrogen. Este un compus instabil, se descompune la expunerea la lumină, căldură și unele metale.
Este un compus foarte util care se folosește la dezinfectarea rănilor minore, albirea părului, tratarea apei etc. Deși poate avea acțiuni nocive pentru oameni, se găsește în toate celulele eucariote ale ființelor vii, unde îndeplinește mai multe funcții benefice.
Peroxidul de hidrogen produce oxidarea substanțelor toxice precum fenoli, etanol, formaldehidă etc., produse care sunt eliminate de ficat și rinichi. În plus, contribuie la distrugerea bacteriilor fagocitate de leucocite neutrofile și macrofage..
Indice articol
- 1 Structură
- 1.1 Molecula
- 1.2 Rotații
- 1.3 Interacțiuni intermoleculare
- 2 Proprietăți
- 2.1 Denumiri
- 2.2 Masa molară
- 2.3 Aspect fizic
- 2.4 Miros
- 2.5 Aromă
- 2.6 Densitate
- 2.7 Punctul de topire
- 2.8 Punctul de fierbere
- 2.9 Solubilitate în apă
- 2.10 Solubilitate
- 2.11 Coeficientul de partiție octanol / apă
- 2.12 Presiunea vaporilor
- 2.13 Constanta de disociere
- 2,14 pH
- 2.15 Indicele de refracție (nD)
- 2.16 Vâscozitatea
- 2.17 Capacitate termică
- 2.18 Căldura de vaporizare
- 2.19 Stabilitate
- 2.20 Coroziune
- 2.21 Descompunerea
- 2.22 Tensiunea superficială
- 2.23 Reactivitate
- 3 utilizări
- 3.1 Albirea
- 3.2 Dezinfectant
- 3.3 Detergent
- 3.4 Aplicare cosmetică
- 3.5 Propulsor
- 4 Obținerea
- 4.1 Hidrogenare
- 4.2 Filtrare
- 4.3 oxidare
- 4.4 Extracția și purificarea
- 5 Riscuri
- 6 Referințe
Structura
Moleculă
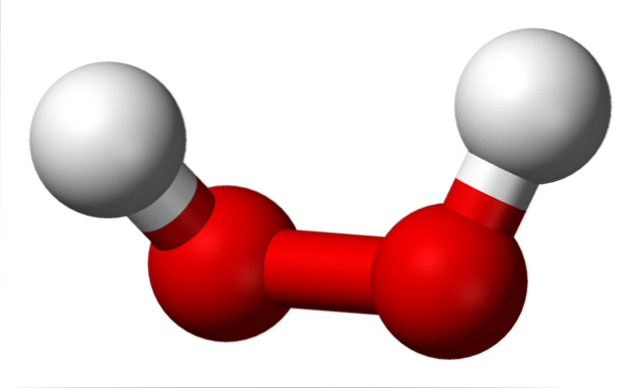
Imaginea superioară arată structura moleculei H.DouăSAUDouă (H-O-O-H), cu sferele roșii corespunzătoare atomilor de oxigen, iar cele albe atomii de hidrogen. Rețineți că molecula nu este plană și că atomii H nu sunt eclipsați în spațiu (unul în fața celuilalt).
Interesant este că la HDouăSAUDouă Este dificil să-și rotească legătura centrală simplă O-O, astfel încât pozițiile acestor H nu pot fi schimbate; una nu va coborî în timp ce cealaltă urcă.
De ce? Deoarece în cei doi atomi de oxigen există două perechi libere de electroni, ceea ce dă un total de opt electroni foarte apropiați care se resping reciproc datorită sarcinilor lor negative..
Rotații
Chiar și așa, legătura O-O este susceptibilă de o ușoară rotație datorită interacțiunilor cu mediul său..
De exemplu, aducând cele două degetele mari împreună, cu degetele arătătoare extinse și cu celelalte închise, ca și cum ar fi desenat o curte, și apoi rotind degetele mari în așa fel încât unul dintre degetele arătătoare să îndrepte înainte și celălalt înapoi, au o reprezentare aproximativă a lui HDouăSAUDouă.
Dacă un corp atinge oricare dintre degetul arătător, degetele mari se vor roti ca răspuns la această interacțiune; cu toate acestea, vor reveni imediat la poziția inițială din cauza respingerilor electronice menționate mai sus. Aceste rotații încadrează astfel aspectele dinamice ale acestei molecule.
Interacțiuni intermoleculare
În stare lichidă HDouăSAUDouă reușește să stabilească legături de hidrogen (HOOH-ODouăHDouă), întrucât altfel punctul său de fierbere ridicat (150 ° C) în comparație cu apa nu ar fi explicat.
Odată ce trece în faza gazoasă, moleculele HDouăSAUDouă probabil nu mai poate forma astfel de punți, datorită nu numai distanței intermoleculare mai mari, ci și atomii de hidrogen ar fi primii care se vor atinge în caz de coliziuni (acest lucru poate fi vizualizat recurgând din nou la modelul degetului).
Între timp, în faza solidă, unghiul planurilor stabilit de H este de 90º (puneți degetele arătătoare perpendiculare). Acum legăturile de hidrogen devin și mai importante, iar moleculele HDouăSAUDouă sunt dispuse într-un cristal cu structură tetragonală.
Proprietăți
s Sticlă cu apă oxigenată. În farmacii se obține cu o concentrație de 3% m / v. Sursa: Pixnio.
Numele
-Apă oxigenată
-Antioxidan
-Oxidanol
-Acid perhidroxic
-O-hidroxiol
-Peroxid
Masă molară
34,0147 g / mol
Aspectul fizic
Lichid albastru pal (concentrat) sau incolor. Este puțin mai vâscos și dens decât apa. Este distilat pentru siguranță la temperaturi scăzute și sub presiune redusă, deoarece se descompune la încălzire într-o formă explozivă.
Miros
Miros ascuțit sau asemănător ozonului.
Gust
Amar
Densitate
Solid 1,71 g / cm3
Densitățile soluțiilor sale apoase depind de concentrația lor; de exemplu, la 27% are o densitate de 1,10 g / cm3, în timp ce la 50%, 1,13 g / cm3
Punct de topire
- 0,43 ºC
Punct de fierbere
150,2 ° C. Această valoare a fost obținută prin extrapolare, deoarece peroxidul de hidrogen se descompune la temperaturi ridicate.
Solubilitatea apei
Miscibil ≥ 100 mg / ml la 25 ° C
Solubilitate
Este solubil în eter și alcooli, dar insolubil în eter de petrol. Se descompune în apă și oxigen în mulți solvenți organici.
Coeficientul de partiție octanol / apă
Jurnal P = - 0,43
Presiunea de vapori
5 mmHg la 30 ºC.
Constanta de disociere
pKa = 11,72
pH
Soluțiile de peroxid de hidrogen sunt ușor acide. De exemplu, un 35% are un pH de 4,6; dar concentrându-se la 90%, pH-ul devine mai puțin acid: 5.1.
Indicele de refracție (nD)
1.4061
Viscozitate
1.245 cPoise la 20 ° C.
Capacitate de căldură
1.267 J / gK (gaz)
2.619 J / gK (lichid)
Căldura de vaporizare
1.519 J / gK
Stabilitate
Stabil în condițiile recomandate. Este stabilizat în continuare prin adăugarea de acetanilid și săruri de staniu.
Coroziune
Coroziv
Descompunere
Se descompune la expunerea la lumină sau în prezența substanțelor oxidante și reducătoare. De asemenea, se descompune la încălzire. Când se descompune, eliberează apă și oxigen și este favorizat de o creștere a pH-ului și temperaturii, precum și de prezența enzimei catalază..
Tensiune de suprafata
80,4 dyne / cm la 20 ° C
Reactivitate
HDouăSAUDouă Acționează ca agent oxidant în soluțiile acide de fier fier (FeDouă+) la fierul feric (F3+); oxidează, de asemenea, ionul sulfit (SO3Două-) la ionul sulfat (SO4Două-).
Poate acționa și ca agent reducător în prezența soluțiilor bazice, reducând hipocloritul de sodiu (NaOCl) și permanganatul de potasiu (KMnO4) cu eliberarea de oxigen.
Aplicații
Albire
Peroxidul de hidrogen este utilizat în industria hârtiei în albirea celulozei și hârtiei, care consumă cea mai mare parte a producției sale anuale.
Dezinfectant
Peroxidul de hidrogen este un antiseptic ușor pentru a preveni infectarea rănilor mici, a zgârieturilor și a arsurilor. Este, de asemenea, utilizat ca apă de gură și pentru ameliorarea iritației ușoare a gurii datorită prezenței aftelor sau a gingivitei..
De asemenea, este utilizat pentru dezinfectarea suprafețelor, a interiorului frigiderelor, a apei și combaterea creșterii excesive a bacteriilor în sistemele de apă și turnurile de răcire. Peroxidul de hidrogen eliberează radicali liberi de oxigen, care descompun poluanții.
Detergent
Peroxidul de hidrogen este utilizat la fabricarea detergenților de albire a rufelor, inclusiv a percarbonatului de sodiu. Acest compus este un complex de carbonat de sodiu și peroxid de hidrogen care, atunci când este dizolvat în apă, se separă în componentele sale.
Aplicare cosmetică
Peroxidul de hidrogen diluat este utilizat la decolorarea părului, înainte de colorare. Este, de asemenea, utilizat pentru albirea dinților, precum și o parte a unei paste de dinți de casă.
Propulsor
Peroxidul de hidrogen este utilizat ca component monopropelent sau oxidant al unei rachete bipropolente. Se descompune eliberând oxigen și apă, o caracteristică care a permis utilizarea sa ca propulsor.
Este pompat într-o celulă de reacție cu prezența unui catalizator care accelerează descompunerea menționată. În acest timp, se produce vapori de apă la temperaturi ridicate.
Când aburul este expulzat printr-un spațiu, acesta produce un impuls. Submarinul V-80, construit în 1940, folosea oxigenul generat din apa oxigenată în turbine; numit sistemul de turbine al lui Walter.
Obținerea
Inițial, peroxidul de hidrogen a fost obținut industrial prin hidroliza persulfatului de amoniu, [(NH4)DouăSDouăSAU8] sau electroliza bisulfatului de amoniu, NH4HSO4.
Peroxidul de hidrogen este obținut în prezent industrial prin utilizarea antrachinonei. Procesul se desfășoară în patru etape: hidrogenare, filtrare, oxidare, extracție și purificare..
Hidrogenare
Alchilantroquinona este hidrogenată prin trecerea hidrogenului gazos printr-un hidrogenator încărcat cu alumină și o cantitate mică de catalizator (paladiu). Temperatura se menține la 45 ° C cu agitare permanentă.
Alchilroquinona este convertită în alchilantrahidroquinonă și tetrahidroalchilantrahidrochinonă, aceasta din urmă fiind selectată pentru confortul său mai mare pentru următoarele proceduri.
Filtrare
Soluția care conține antrachinona hidrogenată este filtrată pentru a elimina urmele de catalizator pe care le poate conține..
Oxidare
Soluția filtrată este oxidată prin trecerea aerului prin ea, formând peroxid de hidrogen cu puritate redusă..
Extracție și purificare
Soluția cu peroxid de hidrogen trece printr-o coloană de extracție lichid-lichid. Apa curge prin coloană, în timp ce soluția cu peroxid de hidrogen este pompată prin ea.
Apa ajunge la fundul extractorului cu o concentrație de peroxid de hidrogen între 25 și 35% g / g. Apoi, este purificat prin distilare sub vid, la o concentrație de peroxid de hidrogen de 30%. În cele din urmă se stabilizează și stochează.
Riscuri
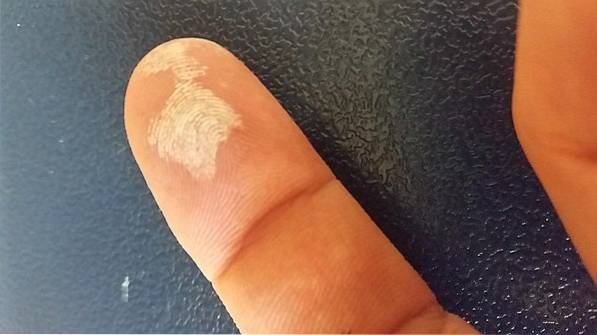
Peroxidul de hidrogen este un agent coroziv, astfel încât la contactul cu pielea provoacă iritații severe, precum și o albire temporară (imaginea de mai sus). De asemenea, poate provoca leziuni oculare, mâncărime, erupții cutanate, roșeață și vezicule..
Inhalarea provoacă iritații la nivelul nasului, gâtului și plămânilor. Între timp, expunerea repetată poate provoca bronșită, tuse, flegmă și dificultăți de respirație. Și, ca și când nu ar fi suficient, generează și dureri de cap, amețeli, greață și vărsături.
Expunerea severă la peroxid de hidrogen poate provoca acumularea de lichid în plămâni, cunoscută sub numele de edem pulmonar - o afecțiune gravă care necesită asistență medicală promptă..
Administrația pentru Sănătate și Siguranță în Muncă (OSHA) a stabilit maximum admisibil pentru peroxidul de hidrogen de 1 ppm într-un mediu de lucru într-o schimbare de 8 ore. Cu toate acestea, deoarece este un compus mutagen, expunerea trebuie menținută la minimum..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Apă oxigenată. Recuperat de pe: en.wikipedia.org
- William R. Busing și Henri A. Levy. (2004). Structura cristalină și moleculară a peroxidului de hidrogen: un studiu de neutroni - difracție. doi.org/10.1063/1.1696379
- Centrul Național pentru Informații despre Biotehnologie. (2019). Apă oxigenată. Baza de date PubChem. CID = 784. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Editorii Enciclopediei Britanice. (27 noiembrie 2018). Apă oxigenată. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Departamentul de Sănătate din New Jersey. (2016). Apă oxigenată. [PDF]. Recuperat de la: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Biochimie. A treia editie. Editura Pearson Addison Wesley
- Web MD. (2019). Apă oxigenată. Recuperat de pe: webmd.com



Nimeni nu a comentat acest articol încă.