
Structura și funcția celulei uscate
A celula uscată este o baterie al cărei mediu electrolitic constă dintr-o pastă și nu o soluție. Respectiva pastă are însă un anumit nivel de umiditate și, din aceste motive, nu este strict uscată..
Cantitatea mică de apă este suficientă pentru mișcarea ionilor și, în consecință, fluxul de electroni în interiorul celulei..

Avantajul său enorm față de primele baterii umede este că, deoarece este o pastă electrolitică, conținutul său nu poate fi vărsat; ceea ce a fost cazul bateriilor umede, care erau mai periculoase și mai delicate decât omologii lor uscați. Având în vedere imposibilitatea deversărilor, celula uscată își găsește utilizarea în multe dispozitive portabile și mobile.
În imaginea de mai sus există o baterie uscată zinc-carbon. Mai exact, este o versiune modernă a stivei Georges Leclanché. Dintre toate, este cel mai comun și poate cel mai simplu.
Aceste dispozitive reprezintă o comoditate energetică datorită faptului că au energie chimică în buzunar care poate fi transformată în electricitate; și în acest fel, nu depinde de prizele de energie sau de energia furnizată de centralele mari și de vasta lor rețea de turnuri și cabluri.
Indice articol
- 1 Structura celulei uscate
- 1.1 Electrozi
- 1.2 Terminale
- 1.3 Nisip și ceară
- 2 Funcționare
- 2.1 Oxidarea electrodului de zinc
- 2.2 Reducerea clorurii de amoniu
- 2.3 Descărcare
- 3 Referințe
Structura celulelor uscate
Care este structura unei celule uscate? În imagine puteți vedea capacul acestuia, care nu este altceva decât un film polimeric, oțel și cele două borne ale căror șaibe izolatoare ies din față.
Cu toate acestea, aceasta este doar aspectul său exterior; cele mai importante părți ale sale se află în interior, ceea ce garantează buna funcționare.
Fiecare celulă uscată va avea propriile caracteristici, dar va fi luată în considerare doar celula zinc-carbon, dintre care se poate contura o structură generală pentru toate celelalte baterii..
Bateria este înțeleasă ca unirea a două sau mai multe baterii, iar acestea din urmă sunt celule voltaice, așa cum se va explica într-o secțiune viitoare..
Electrozi
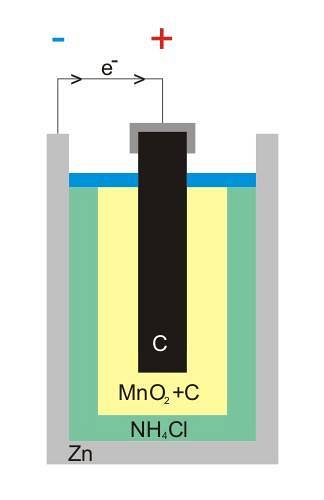
Imaginea superioară arată structura internă a unei baterii zinc-carbon. Indiferent care este celula voltaică, ar trebui să existe întotdeauna (de obicei) doi electrozi: unul din care se degajă electroni și altul care îi primește..
Electrozii sunt materiale conductoare electric și, pentru a exista curent, ambii trebuie să aibă electronegativități diferite.
De exemplu, zincul, o tablă albă care închide bateria, este locul în care pleacă electronii către circuitul electric (dispozitivul) unde este conectat.
Pe de altă parte, în întregul mediu se află electrodul de carbon grafitic; cufundat și într-o pastă compusă din NH4Cl, ZnClDouă și MnODouă.
Acest electrod este cel care primește electronii și rețineți că are simbolul „+”, ceea ce înseamnă că este borna pozitivă a bateriei.
Terminale
După cum se vede deasupra tijei de grafit din imagine, există terminalul electric pozitiv; iar dedesubt, cutia interioară de zinc din care curg electroni, terminalul negativ.
Acesta este motivul pentru care bateriile au semne „+” sau „-” pentru a indica modul corect de conectare la dispozitiv și, astfel, pentru a-l porni..
Nisip și ceară
Deși nu este prezentată, pasta este protejată de un nisip tampon și o garnitură de ceară care împiedică vărsarea sau intrarea în contact cu oțelul la impacturi mecanice minore sau agitație..
Funcționarea
Cum funcționează o celulă uscată? Pentru început, este o celulă voltaică, adică generează electricitate din reacții chimice. Prin urmare, în interiorul celulelor apar reacții redox, unde speciile câștigă sau pierd electroni..
Electrozii servesc ca o suprafață care facilitează și permite dezvoltarea acestor reacții. În funcție de sarcinile lor, poate apărea oxidarea sau reducerea speciei.
Pentru a înțelege mai bine acest lucru, vor fi explicate doar aspectele chimice ale bateriei zinc-carbon..
Oxidarea electrodului de zinc
De îndată ce dispozitivul electronic este pornit, bateria va elibera electroni prin oxidarea electrodului de zinc. Aceasta poate fi reprezentată de următoarea ecuație chimică:
Zn => ZnDouă+ + 2e--
Dacă există mult ZnDouă+ în jurul metalului, va avea loc o polarizare a sarcinii pozitive, deci nu va mai exista oxidare. Prin urmare, ZnDouă+ trebuie să difuzeze prin pastă spre catod, unde electronii vor intra înapoi.
Odată ce electronii au activat artefactul, aceștia se întorc la celălalt electrod: cel de grafit, pentru a găsi unele specii chimice care „îl așteaptă”..
Reducerea clorurii de amoniu
După cum sa menționat anterior, există NH în paste4Cl și MnODouă, substanțe care-i fac pH-ul acid. De îndată ce electronii intră, vor apărea următoarele reacții:
2NH4+ + 2e- => 2NH3 + HDouă
Cele două produse, amoniac și hidrogen molecular, NH3 si HDouă, sunt gaze și, prin urmare, pot „umfla” bateria dacă nu suferă alte transformări; precum următoarele două:
ZnDouă+ + 4NH3 => [Zn (NH3)4]Două+
HDouă + 2MnODouă => 2MnO (OH)
Rețineți că amoniul a fost redus (a câștigat electroni) pentru a deveni NH3. Aceste gaze au fost apoi neutralizate de celelalte componente ale pastei..
Complexul [Zn (NH3)4]Două+ facilitează difuzia ionilor ZnDouă+ spre catod și astfel se previne „blocarea” bateriei.
Circuitul extern al artefactului funcționează ca o punte pentru electroni; altfel nu ar exista niciodată o legătură directă între cutia de zinc și electrodul de grafit. În imaginea structurii, acest circuit ar reprezenta cablul negru.
Descarca
Celulele uscate vin în multe variante, dimensiuni și tensiuni de lucru. Unele dintre ele nu sunt reîncărcabile (celule voltaice primare), în timp ce altele sunt (celule voltaice secundare).
Bateria zinc-carbon are o tensiune de lucru de 1,5V. Formele lor se schimbă în funcție de electrozii lor și de compoziția electroliților lor..
Va veni un moment în care tot electrolitul a reacționat și, indiferent cât de mult este oxidat zincul, nu vor exista specii care să primească electronii și să promoveze eliberarea lor..
În plus, poate fi cazul în care gazele formate nu mai sunt neutralizate și rămân exercitate presiune în interiorul bateriilor..
Bateriile din zinc-carbon și alte baterii care nu sunt reîncărcabile trebuie reciclate; deoarece componentele sale, în special componentele nichel-cadmiu, sunt dăunătoare mediului înconjurător prin solurile și apele poluante.
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Bateria „Dry-Cell”. Recuperat de la: makahiki.kcc.hawaii.edu
- Hoffman S. (10 decembrie 2014). Ce este o baterie cu celule uscate? Recuperat de pe: upsbatterycenter.com
- Weed, Geoffrey. (24 aprilie 2017). Cum funcționează bateriile cu celule uscate? Știința. Recuperat de pe: sciencing.com
- Woodford, Chris. (2016) Baterii. Recuperat de pe: explainthatstuff.com.



Nimeni nu a comentat acest articol încă.