
Proprietățile periodice ale elementelor și caracteristicile acestora

Proprietățile periodice ale elementelor sunt cele care definesc comportamentul lor fizic și chimic dintr-o perspectivă atomică și ale căror magnitudini, pe lângă numărul atomic, permit o clasificare a atomilor.
Dintre toate proprietățile, acestea sunt caracterizate, așa cum indică și numele lor, pentru că sunt periodice; adică, dacă se studiază tabelul periodic, va fi posibil să se certifice că magnitudinile sale respectă o tendință care coincide și se repetă cu ordonarea elementelor din puncte (rânduri) și grupuri (coloane).

De exemplu, dacă o perioadă este parcursă și o proprietate periodică scade în magnitudine cu fiecare element, același lucru i se va întâmpla în toate perioadele. Pe de altă parte, dacă coborârea unui grup sau coloană crește magnitudinea acestuia, se poate aștepta să se întâmple la fel și pentru celelalte grupuri..
Și astfel, variațiile sale se repetă și arată o tendință simplă care este de acord cu ordonarea elementelor după numărul lor atomic. Aceste proprietăți sunt direct responsabile de caracterul metalic sau nemetalic al elementelor, precum și de reactivitățile lor, ceea ce a ajutat la clasificarea lor în profunzime mai mare..
Dacă pentru o clipă identitatea elementelor era necunoscută și erau văzute ca „sfere” ciudate, tabelul periodic ar putea fi reconstruit (cu multă muncă) folosind aceste proprietăți.
În acest fel, sferele presupuse ar dobândi culori care să le permită să fie diferențiate între ele în grupuri (imaginea superioară). Cunoscând caracteristicile lor electronice, acestea ar putea fi organizate în perioade, iar grupurile le-ar dezvălui pe acelea care au același număr de electroni de valență.
Învățarea și raționamentul despre proprietățile periodice este la fel ca a ști de ce reacționează elementele într-un fel sau altul; este de a ști de ce elementele metalice se află în anumite regiuni ale tabelului și elementele nemetalice în alta.
Indice articol
- 1 Care sunt proprietățile periodice și caracteristicile lor
- 1.1 -Raza atomică
- 1.2 -Electronegativitate
- 1.3 -Caracter metalic
- 1.4 -Energia de ionizare
- 1.5 -Afinitatea electronică
- 2 Referințe
Care sunt proprietățile periodice și caracteristicile lor
-Radio atomic
La observarea sferelor din imagine, primul lucru care poate fi observat este că nu au toate aceeași dimensiune. Unele sunt mai voluminoase decât altele. Dacă priviți mai atent, veți descoperi că aceste dimensiuni variază în funcție de un model: într-o perioadă scade de la stânga la dreapta, iar într-un grup crește de sus în jos..
Cele de mai sus se pot spune și astfel: raza atomică scade spre grupurile sau coloanele din dreapta și crește în perioadele sau rândurile inferioare. Acesta fiind cazul, raza atomică este prima proprietate periodică, deoarece variațiile sale urmează un model în cadrul elementelor..
Încărcare nucleară vs electroni
De ce acest tipar? Într-o perioadă, electronii atomului ocupă același nivel de energie, care este legat de distanța care îi separă de nucleu. Când ne deplasăm de la un grup la altul (care este același lucru cu parcurgerea perioadei din dreapta), nucleul adaugă atât electroni, cât și protoni în același nivel de energie..
Prin urmare, electronii nu pot ocupa distanțe suplimentare față de nucleu, ceea ce îi mărește sarcina pozitivă, deoarece are mai mulți protoni. În consecință, electronii experimentează o forță mai mare de atracție către nucleu, atrăgându-i din ce în ce mai mult pe măsură ce crește numărul de protoni..
De aceea elementele din extrema dreaptă a tabelului periodic (coloane galbene și turcoaz) au cele mai mici raze atomice..
Pe de altă parte, atunci când „săriți” dintr-o perioadă în alta (ceea ce este același lucru cu a spune că coborâți într-un grup), noile niveluri de energie activate permit electronilor să ocupe spații mai îndepărtate de nucleu. Fiind mai departe, nucleul (cu mai mulți protoni) îi atrage cu mai puțină forță; iar razele atomice cresc deci.
Raze ionice
Razele ionice urmează un model similar cu razele atomice; Cu toate acestea, acestea nu depind atât de mult de nucleu, ci de câți sau mai puțini electroni are atomul în raport cu starea sa neutră.
Cationii (Na+, ACDouă+, Pentru3+, FiDouă+, Credinţă3+) prezintă o sarcină pozitivă deoarece au pierdut unul sau mai mulți electroni și, prin urmare, nucleul îi atrage cu o forță mai mare, deoarece există mai puține repulsii între ei. Rezultatul: cationii sunt mai mici decât atomii din care sunt derivați.
Și pentru anioni (ODouă-, F-, SDouă-, Eu-) dimpotrivă, prezintă sarcină negativă deoarece au unul sau mai mulți electroni în exces, crescându-și repulsiile între ele deasupra atracției exercitate de nucleu. Rezultatul: anionii sunt mai mari decât atomii din care sunt derivați (imaginea de mai jos).
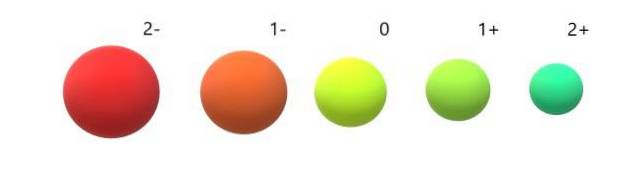
Se apreciază că anionul 2 este cel mai voluminos dintre toate, iar cationul 2+ cel mai mic. Razele cresc atunci când atomul este încărcat negativ și se contractă atunci când este încărcat pozitiv..
-Electronegativitate
Când elementele au raze atomice mici, nu numai că electronii lor sunt atrași foarte puternic, ci și electronii din atomii vecini atunci când formează o legătură chimică. Această tendință de a atrage electroni din alți atomi din interiorul unui compus este cunoscută sub numele de electronegativitate..
Doar pentru că un atom este mic nu înseamnă că va fi mai electronegativ. Dacă da, elementele heliu și hidrogen ar fi atomii cei mai electronegativi. Heliul, din câte a demonstrat știința, nu formează o legătură covalentă de niciun fel; iar hidrogenul are doar un singur proton în nucleu.
Când razele atomice sunt mari, nucleele nu au suficientă forță pentru a atrage electronii din alți atomi; de aceea, cele mai electronegative elemente sunt cele cu o rază atomică mică și un număr mai mare de protoni.
Din nou, cei care îndeplinesc perfect aceste caracteristici sunt elementele nemetalice ale blocului p al tabelului periodic; Acestea sunt cele aparținând grupului 16 sau oxigenului (O, S, Se, Te, Po) și grupului 17 sau fluorului (F, Cl, Br, I, At).
Tendinţă
Conform tuturor celor spuse, cele mai electronegative elemente sunt situate în special în colțul din dreapta sus al tabelului periodic; având fluorul ca element care conduce lista celor mai electronegative.
De ce? Fără a recurge la scale de electronegativitate (Pauling, Mulliken etc.), deși fluorul este mai mare decât neonul (gazul nobil al perioadei sale), primul poate forma legături, în timp ce cel din urmă nu. În plus, pentru dimensiunea sa mică, nucleul său are mulți protoni, iar acolo unde este fluorul, va exista un moment dipolar.
-Personaj metalic
Dacă un element are o rază atomică în comparație cu cele din aceeași perioadă și, de asemenea, nu este foarte electronegativ, atunci este un metal și are un caracter metalic ridicat.
Dacă ne întoarcem la imaginea principală, sferele roșiatice și verzui, precum cele cenușii, corespund unor elemente metalice. Metalele au caracteristici unice, iar de aici proprietățile periodice încep să se împletească cu proprietățile fizice și macroscopice ale materiei..
Elementele cu un caracter metalic ridicat se caracterizează prin atomii lor relativ mari, ușor de pierdut electroni, deoarece nucleele cu greu îi pot atrage spre ei..
Ca rezultat, aceștia sunt ușor oxidați sau se pierd electroni pentru a forma cationi, M+; asta nu înseamnă că toți cationii sunt metalici.
Tendinţă
În acest moment puteți prezice modul în care caracterul metalic variază în tabelul periodic. Dacă se știe că metalele au raze metalice mari și că sunt, de asemenea, puține electronegative, ar trebui să ne așteptăm ca elementele cele mai grele (perioadele inferioare) să fie cele mai metalice; iar cele mai ușoare elemente (perioadele superioare), cu atât mai puțin metalice.
De asemenea, caracterul metalic scade cu cât devine mai electronegativ elementul. Aceasta înseamnă că parcurgând perioadele și grupurile din dreapta tabelului periodic, în perioadele lor superioare, vor găsi elementele mai puțin metalice..
Prin urmare, caracterul metalic crește descendent printr-un grup și scade de la stânga la dreapta în aceeași perioadă. Printre elementele metalice avem: Na (sodiu), Li (litiu), Mg (magneziu), Ba (bariu), Ag (argint), Au (aur), Po (poloniu), Pb (plumb), Cd (cadmiu) ), Al (aluminiu) etc..
-Energie de ionizare
Dacă un atom are o rază atomică mare, este de așteptat ca nucleul său să nu țină electroni în cochiliile exterioare prinse cu o forță considerabilă. În consecință, îndepărtarea lor din atom în faza gazoasă (individualizată) nu va necesita multă energie; adică energia de ionizare, EI, necesară pentru a elimina un electron din ele.
EI este, de asemenea, echivalent cu a spune că este energia care trebuie furnizată pentru a depăși forța de atracție a nucleului unui atom sau a ionului gazos pe electronul său cel mai exterior. Cu cât atomul este mai mic și cu atât este mai electronegativ, cu atât este mai scăzut EI; acesta este trendul tău.
Următoarea ecuație ilustrează un exemplu:
Na (g) => Na+(g) + e-
EI necesar pentru a realiza acest lucru nu este atât de mare în comparație cu a doua ionizare:
N / A+(g) => NaDouă+(g) + e-
Din moment ce în Na+ predomină sarcinile pozitive, iar ionul este mai mic decât atomul neutru. În consecință, nucleul Na+ atrage electronii cu o forță mult mai mare, necesitând un EI mult mai mare.
-Afinitate electronică
Și, în cele din urmă, există proprietatea periodică a afinității electronice. Aceasta este tendința energetică a atomului unui element în faza gazoasă de a accepta un electron. Dacă atomul este mic și are un nucleu cu o forță atractivă mare, îi va fi ușor să accepte electronul, formând un anion stabil..
Cu cât anionul este mai stabil în raport cu atomul său neutru, cu atât este mai mare afinitatea sa de electroni. Totuși, repulsiile dintre electroni înșiși intră și ele în joc.
Azotul, de exemplu, are o afinitate electronică mai mare decât oxigenul. Acest lucru se datorează faptului că cei trei electroni ai săi 2p nu sunt împerecheați și se resping reciproc, iar electronul de intrare mai puțin; în timp ce în oxigen, există o pereche de electroni împerecheați care exercită o respingere electronică mai mare; iar în fluor, există două perechi.
Din acest motiv, se spune că tendința în afinitățile electronice se normalizează din a treia perioadă a tabelului periodic..
Referințe
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Prof. Ortega Graciela M. (1 aprilie 2014). Proprietățile periodice ale elementelor. Culoare abc. Recuperat de pe: abc.com.py
- Chimie LibreTexte. (7 iunie 2017). Proprietățile periodice ale elementelor. Recuperat de pe: chem.libretexts.org
- Helmenstine, Anne Marie, dr. (02 ianuarie 2019). Proprietățile periodice ale elementelor. Recuperat de pe: thoughtco.com
- Toppr. (s.f.). Proprietățile periodice ale elementelor. Recuperat de pe: toppr.com /
- Proprietățile periodice ale elementelor: o călătorie peste masă este o călătorie prin chimie. [PDF]. Recuperat din: cod.edu



Nimeni nu a comentat acest articol încă.