
Ce este un atom neutru? (Cu exemple)
A atom neutru Este una care lipsește o încărcare electrică datorită unei compensări între numărul de protoni și electroni. Ambele sunt particule subatomice încărcate electric.
Protonii sunt aglomerați împreună cu neutronii și alcătuiesc nucleul; în timp ce electronii sunt estompați definind un nor electronic. Când numărul de protoni dintr-un atom, egal cu numărul său atomic (Z), este egal cu numărul de electroni, se spune că există un compromis între sarcinile electrice din interiorul atomului..

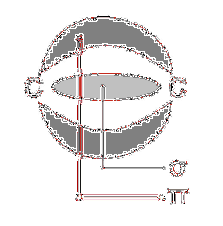
Există, de exemplu, un atom de hidrogen (imaginea superioară), care are un proton și un electron. Protonul se poziționează în centrul atomului ca nucleu, în timp ce electronul orbitează spațiul înconjurător, lăsând regiuni cu densitate mai mică a electronilor pe măsură ce se îndepărtează de nucleu..
Acesta este un atom neutru, deoarece Z este egal cu numărul de electroni (1p = 1e). Dacă atomul H ar pierde acel singur proton, raza atomică s-ar micșora și sarcina protonului ar prevala, devenind cationul H+ (hidron). Dacă, pe de altă parte, ar câștiga un electron, ar exista doi electroni și ar deveni anionul H-- (hidrură).
Indice articol
- 1 Atom neutru vs ion
- 1.1 Na vs Na+
- 2 molecule neutre
- 3 Exemple
- 3.1 Oxigen
- 3.2 Cupru
- 3.3 Gazele nobile
- 3.4 Aliaje metalice
- 4 Referințe
Atom neutru vs ion
Pentru exemplul atomului H neutru, s-a constatat că numărul de protoni este egal cu numărul de electroni (1p = 1e); situație care nu apare cu ionii derivați de pierderea sau câștigul unui electron.
Ionii se formează printr-o modificare a numărului de electroni, fie datorită atomului care îi câștigă (-), fie că îi pierde (+).
În atomul cationului H+ sarcina de valență a protonului solitar predomină asupra absenței totale a unui electron (1p> 0e). Acest lucru este valabil pentru toți ceilalți atomi mai grei (np> ne) din tabelul periodic..
Deși prezența unei sarcini pozitive poate părea nesemnificativă, aceasta schimbă în diagonală caracteristicile elementului în cauză..
Pe de altă parte, în atomul anionului H- sarcina negativă a celor doi electroni predomină împotriva protonului unic din nucleu (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs Na+
Un exemplu mai cunoscut este cel al sodiului metalic. Atomul său neutru, Na, cu Z = 11, are 11 protoni; de aceea trebuie să existe 11 electroni pentru a compensa sarcinile pozitive (11p = 11e).
Sodiul, fiind un element metalic extrem de electropozitiv, își pierde foarte ușor electronii; în acest caz, pierde doar unul, cel al stratului său de valență (11p> 10e). Astfel, se formează cationul Na+, care interacționează electrostatic cu un anion; sub formă de clorură, Cl-, în sarea de clorură de sodiu, NaCI.
Sodiul metalic este otrăvitor și coroziv, în timp ce cationul său este chiar prezent în celule. Aceasta arată cum proprietățile unui element se pot schimba drastic atunci când câștigă sau pierde electroni..
Pe de altă parte, anionul Na- (soduro, ipotetic) nu există; și dacă s-ar putea forma, ar fi extrem de reactiv, deoarece se opune naturii chimice a sodiului pentru a câștiga electroni. Apoi o- ar avea 12 electroni, depășind sarcina pozitivă a nucleului său (11p<12e).
Molecule neutre
Atomii sunt legați covalent pentru a da naștere la molecule, care pot fi numite și compuși. În cadrul unei molecule nu pot exista ioni izolați; în schimb, există atomi cu sarcini formale pozitive sau negative. Acești atomi încărcați afectează sarcina netă a moleculei, transformând-o într-un ion poliatomic.
Pentru ca o moleculă să fie neutră, suma sarcinilor formale ale atomilor săi trebuie să fie egală cu zero; sau, mai simplu, toți atomii săi sunt neutri. Dacă atomii care alcătuiesc o moleculă sunt neutri, acest lucru va fi și ei.
De exemplu, avem molecula de apă, HDouăO. Cei doi atomi ai săi H sunt neutri, la fel și atomul de oxigen. Ele nu pot fi reprezentate în același mod ca în imaginea atomului de hidrogen; deoarece, deși nucleul nu se schimbă, norul electronic se schimbă.
Ionul hidroniu, H3SAU+, pe de altă parte, are un atom de oxigen cu o sarcină parțială pozitivă. Aceasta înseamnă că în acest ion poliatomic pierde un electron și, prin urmare, numărul său de protoni este mai mare decât cel al electronilor săi..
Exemple
Oxigen
Atomul neutru de oxigen are 8 protoni și 8 electroni. Când câștigă doi electroni, formează ceea ce este cunoscut sub numele de anion oxid, ODouă-. În acesta predomină sarcinile negative, cu un exces de doi electroni (8p<10e).
Atomii neutri de oxigen au o tendință ridicată de a reacționa și de a se lega cu ei înșiși pentru a forma ODouă. Din acest motiv, nu există atomi de O "liberi" acolo singuri și fără să reacționeze cu nimic. Toate reacțiile cunoscute pentru acest gaz sunt atribuite oxigenului molecular, ODouă.
Cupru
Cuprul are 29 de protoni și 29 de electroni (pe lângă neutroni). Spre deosebire de oxigen, atomii săi neutri pot fi găsiți în natură datorită legăturii sale metalice și stabilității relative.
La fel ca sodiul, tinde să piardă electroni, mai degrabă decât să-i câștige. Având în vedere configurația sa electronică și pentru alte aspecte, poate pierde unul sau doi electroni, devenind cationii cupruși, Cu+, sau cupric, CuDouă+, respectiv.
Cationul Cu+ are un electron mai puțin (29p<28e), y el CuDouă+ a pierdut doi electroni (29p<27e).
gaze nobile
Gazele nobile (He, Ne, Ar, Kr, Xe, Rn), sunt unul dintre puținele elemente care există sub forma atomilor lor neutri. Numerele lor atomice sunt: 2, 10, 18, 36, 54 și respectiv 86. Nu câștigă sau pierd electroni; deși, xenonul, Xe, poate forma compuși cu fluor și poate pierde electroni.
Aliaje metalice
Dacă sunt protejate de coroziune, metalele își pot menține atomii neutri, ținuți împreună de legături metalice. În aliaje, soluții solide de metale, atomii rămân (în cea mai mare parte) neutri. În alamă, de exemplu, există atomi neutri de Cu și Zn.
Referințe
- Jetser Carasco. (2016). Ce este un atom neutru? Recuperat de la: introduction-to-physics.com
- Marcaje, Samuel. (25 aprilie 2017). Exemple de atomi non-neutri. Știința. Recuperat de pe: sciencing.com
- Chem4kids. (2018) .Uitându-ne la Ioni. Recuperat de pe: chem4kids.com
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.

Nimeni nu a comentat acest articol încă.