
Ce este o soluție diluată? factori și exemple
A Soluție diluată sau nesaturateEste o soluție chimică care nu a atins concentrația maximă de dizolvat dizolvat într-un solvent. Solutul suplimentar se va dizolva atunci când este adăugat la o soluție diluată și nu va apărea în faza apoasă..
Din punct de vedere fizico-chimic, o soluție nesaturată este considerată o stare de echilibru dinamic în care ratele la care solventul dizolvă substanța dizolvată sunt mai mari decât rata de recristalizare..
Un exemplu de soluție diluată este ilustrat în Figura 1. În figura 1.1, 1.2 și 1.3 există un volum constant de apă în pahar.
În figura 1.1 procesul începe în cazul în care solutul începe să se dizolve, reprezentat de săgețile roșii. În acest caz, se văd două faze, un lichid și un solid.
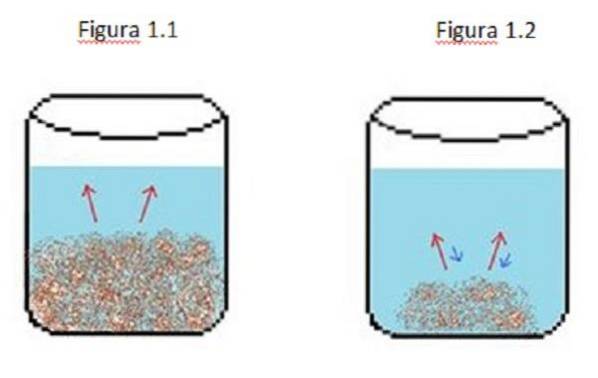
În Figura 1.2, o mare parte din solid s-a dizolvat, dar nu complet datorită procesului de recristalizare, reprezentat de săgețile albastre..
În acest caz, săgețile roșii sunt mai mari decât săgețile albastre, ceea ce înseamnă că rata de diluare este mai mare decât rata de recristalizare. În acest moment aveți o soluție nesaturată.
Astfel, putem spune că o soluție diluată poate dizolva mai mult solut în ea până ajunge la punctul de saturație. La punctul de saturație, nu se va dizolva mai mult dizolvat în solvent și o astfel de soluție se numește soluție saturată..
În acest fel, soluțiile sunt inițial nesaturate în natură și în cele din urmă devin soluții saturate prin adăugarea de solut în el..
Ce este o soluție diluată?
O soluție diluată este acea soluție nesaturată, saturată sau suprasaturată la care se adaugă mai mult solvent. Rezultatul este o soluție nesaturată cu concentrație mai mică.
Diluțiile sunt un proces obișnuit într-un laborator chimic. În general, lucrați cu soluții diluate care sunt realizate din soluții stoc care sunt cele care sunt achiziționate direct de la un anumit comerciant.
Pentru a face diluțiile, se folosește formula C1V1= CDouăVDouă unde C este concentrația soluției, în general în termeni de molaritate sau normalitate. V este volumul soluției în ml și termenii 1 și 2 corespund soluțiilor concentrate și respectiv diluate.
Factori care afectează solubilitatea
Cantitatea de dizolvat care poate fi dizolvat într-un solvent va depinde de diferiți factori, printre care cei mai importanți sunt:
1- Temperatura
Solubilitatea crește odată cu temperatura. De exemplu, mai multă sare poate fi dizolvată în apă fierbinte decât în apă rece..
Cu toate acestea, pot exista excepții, de exemplu, solubilitatea gazelor în apă scade odată cu creșterea temperaturii..
În acest caz, moleculele dizolvate primesc energie cinetică pe măsură ce se încălzesc, ceea ce facilitează evadarea lor..
2- Presiune
Presiunea crescută poate forța dizolvarea solutului. Aceasta este folosită în mod obișnuit pentru dizolvarea gazelor în lichide..
3- Compoziția chimică
Natura solutului și solventului și prezența altor compuși chimici în soluție afectează solubilitatea..
De exemplu, mai mult zahăr poate fi dizolvat în apă decât sare în apă. În acest caz se spune că zahărul este mai solubil.
Etanolul și apa sunt complet solubile între ele. În acest caz particular, solventul va fi compusul găsit în cea mai mare cantitate.
4- Factori mecanici
Spre deosebire de viteza de dizolvare, care depinde în principal de temperatură, rata de recristalizare depinde de concentrația solutului de pe suprafața rețelei de cristal, care este favorizată atunci când o soluție este imobilă..
Prin urmare, agitarea soluției previne această acumulare, maximizând dizolvarea..
Curbele de saturație și solubilitate
Curbele de solubilitate sunt o bază de date grafică în care se compară cantitatea de dizolvat care se dizolvă într-o cantitate de solvent, la o anumită temperatură.
Curbele de solubilitate sunt reprezentate în mod obișnuit pentru o cantitate de substanță dizolvată, fie solidă, fie gazoasă, în 100 de grame de apă. Curbele de saturație pentru diferite substanțe dizolvate în apă sunt ilustrate în Figura 2..
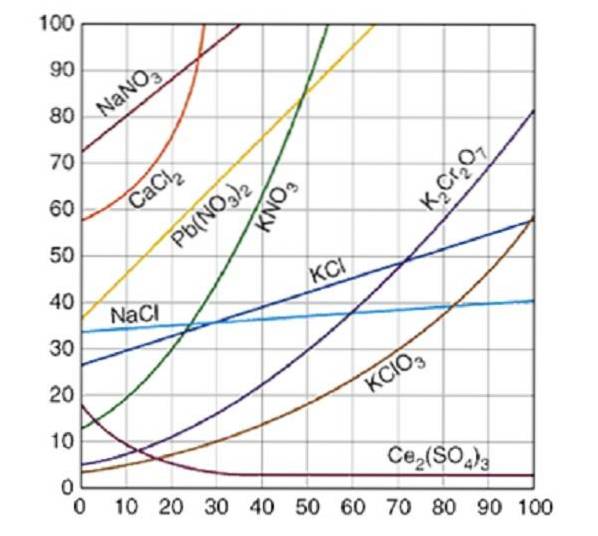
Curba indică punctul de saturație la o temperatură dată. Zona de sub curbă indică faptul că aveți o soluție nesaturată și, prin urmare, se poate adăuga mai mult solut. În zona de deasupra curbei există o soluție suprasaturată.
Luând ca exemplu clorura de sodiu (NaCI), la 25 de grade Celsius, aproximativ 35 de grame de NaCI pot fi dizolvate în 100 de grame de apă pentru a obține o soluție saturată.
Exemple de soluții diluate
Soluțiile nesaturate pot fi găsite zilnic, nu este necesar să se afle într-un laborator chimic.
Solventul nu trebuie neapărat să fie apă. Mai jos sunt exemple zilnice de soluții diluate:
- Adăugarea unei linguri de zahăr la o ceașcă de cafea fierbinte produce o soluție de zahăr nesaturat.
- Oțetul este o soluție diluată de acid acetic în apă.
- Ceața este o soluție nesaturată (dar aproape de saturată) de vapori de apă în aer.
- HCl 0,01 M este o soluție nesaturată de acid clorhidric în apă.
- Alcoolul de frecare este o soluție diluată de alcool izopropilic în apă.
- Supa este o soluție nesaturată de apă și clorură de sodiu.
- Băuturile alcoolice sunt soluții diluate de etanol și apă. De obicei, este indicat procentul de alcool pe care îl au.
Referințe
- Anne Marie Helmenstine, P. (2016, 7 iulie). Definiție și exemple de soluție saturată. Recuperat de la about.com.
- Universitatea Cambrige. (s.f.). Curbele de solubilitate. Recuperat de la dynamiccience.com.au.
- Exemple de soluție saturată. (s.f.). Recuperat de pe example.yourdcitionary.com.
- J., S. (2014, 4 iunie). Soluții saturate și suprasaturate. Recuperat de la socratic.org.
- James, N. (s.f.). Soluție saturată: definiție și exemple. Recuperat de la study.com.
- M., B. (2014, 14 octombrie). Soluții saturate și suprasaturate. Recuperat de la socratic.org.
- Curbele de solubilitate. (s.f.). Recuperat de la kentchemistry.com.
- Sfaturi de saturație. (2014, 26 iunie). Recuperat de la chem.libretexts.org.


Nimeni nu a comentat acest articol încă.