
Ce sunt soluțiile apoase? (Cu exemple)
soluții apoase sunt acele soluții care folosesc apa pentru a descompune o substanță. De exemplu, apa cu nămol sau zahăr. Când o specie chimică s-a dizolvat în apă, aceasta este notată prin scrierea (aq) după denumirea chimică.
Substanțele hidrofile (iubitoare de apă) și mulți compuși ionici se dizolvă sau se disociază în apă. De exemplu, când sarea de masă sau clorura de sodiu se dizolvă în apă, se disociază în ionii săi pentru a forma Na + (aq) și Cl- (aq).

Substanțele hidrofobe (înfricoșate de apă) nu se dizolvă în general în apă și nu formează soluții apoase. De exemplu, amestecul de ulei și apă nu duce la dizolvare sau disociere.
Mulți compuși organici sunt hidrofobi. Non-electroliții se pot dizolva în apă, dar nu se disociază în ioni și își mențin integritatea ca molecule. Exemple de non-electroliți includ zahăr, glicerol, uree și metilsulfonilmetan (MSM).
Proprietățile soluțiilor apoase
Soluțiile apoase conduc adesea electricitatea. Soluțiile care conțin electroliți puternici tind să fie conductori electrici buni (de exemplu, apă de mare), în timp ce soluțiile care conțin electroliți slabi tind să fie conductori slabi (de exemplu, apă de la robinet).
Motivul este că electroliții puternici se disociază complet în ioni în apă, în timp ce electroliții slabi se disociază incomplet..
Când reacțiile chimice dintre specii apar într-o soluție apoasă, reacțiile sunt de obicei reacții cu dublă deplasare (numite și metateze sau dublă substituție)..
În acest tip de reacție, cationul dintr-un reactiv ia locul cationului în celălalt reactiv, formând de obicei o legătură ionică. Un alt mod de gândire este că ionii reactivi „schimbă partenerii”.
Reacțiile în soluție apoasă pot produce produse care sunt solubile în apă sau pot produce un precipitat..
Un precipitat este un compus cu o solubilitate redusă care deseori cade din soluție ca solid..
Termenii acid, bază și pH se aplică numai soluțiilor apoase. De exemplu, puteți măsura pH-ul sucului de lămâie sau al oțetului (două soluții apoase) și sunt acizi slabi, dar nu puteți obține informații semnificative din testul uleiului vegetal cu hârtie pH..
De ce unele solide se dizolvă în apă?
Zahărul pe care îl folosim pentru a îndulci cafeaua sau ceaiul este un solid molecular, în care moleculele individuale sunt ținute împreună de forțe intermoleculare relativ slabe..
Când zahărul se dizolvă în apă, legăturile slabe dintre moleculele de zaharoză individuale se rup, iar aceste molecule C12H22O11 sunt eliberate în soluție..
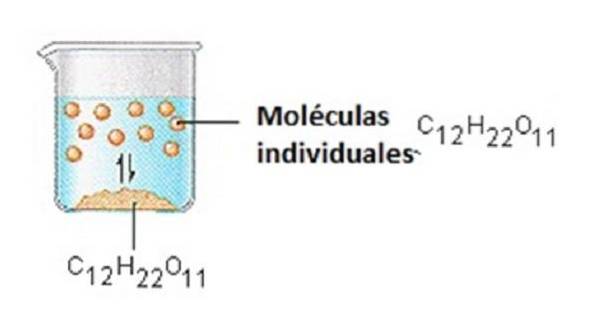
Este nevoie de energie pentru a rupe legăturile dintre moleculele C12H22O11 din zaharoză. De asemenea, este nevoie de energie pentru a sparge legăturile de hidrogen din apă, care trebuie rupte pentru a introduce una dintre aceste molecule de zaharoză în soluție..
Zahărul se dizolvă în apă deoarece energia este eliberată atunci când moleculele de zaharoză ușor polare formează legături intermoleculare cu moleculele de apă polare..
Legăturile slabe care se formează între solvent și solvent compensează energia necesară pentru a modifica structura atât a solventului pur, cât și a solventului..
În cazul zahărului și apei, acest proces funcționează atât de bine încât până la 1800 de grame de zaharoză pot fi dizolvate într-un litru de apă..
Solidele ionice (sau sărurile) conțin ioni pozitivi și negativi, care sunt ținuți împreună datorită forței mari de atracție dintre particulele cu sarcini opuse.
Când unul dintre aceste solide se dizolvă în apă, ionii care alcătuiesc solidul sunt eliberați în soluție, unde se asociază cu moleculele de solvent polar..
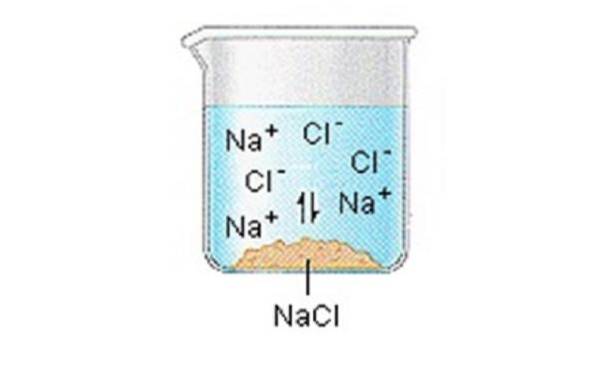
NaCI (s) ”Na + (aq) + Cl- (aq)
În general, putem presupune că sărurile se disociază în ionii lor atunci când sunt dizolvate în apă..
Compușii ionici se dizolvă în apă dacă energia eliberată atunci când ionii interacționează cu moleculele de apă depășește energia necesară pentru a sparge legăturile ionice din solid și energia necesară pentru a separa moleculele de apă, astfel încât ionii să poată fi introduși în soluție.
Reguli de solubilitate
În funcție de solubilitatea unui dizolvat, există trei rezultate posibile:
1) Dacă soluția are mai puțin dizolvat decât cantitatea maximă pe care este capabilă să o dizolve (solubilitatea sa), este o soluție diluată;
2) Dacă cantitatea de dizolvat este exact aceeași cantitate ca solubilitatea sa, este saturată;
3) Dacă există mai mult solut decât este capabil să se dizolve, excesul de solut se separă de soluție.
Dacă acest proces de separare include cristalizarea, formează un precipitat. Precipitațiile reduc concentrația solutului la saturație pentru a crește stabilitatea soluției..
Următoarele sunt regulile de solubilitate pentru solidele ionice comune. Dacă două reguli par să se contrazică reciproc, cea precedentă are prioritate.
1- Săruri care conțin elemente din grupa I (Li+, N / A+, K+, Cs+, Rb+) sunt solubile. Există puține excepții de la această regulă. Săruri care conțin ionul de amoniu (NH4+) sunt, de asemenea, solubile.
2- Săruri care conțin nitrați (NO3-) sunt în general solubile.
3- Sărurile care conțin Cl -, Br - sau I - sunt în general solubile. Excepții importante de la această regulă sunt sărurile de halogenuri ale Ag+, Pb2+ și (Hg2)Două+. Astfel, AgCl, PbBrDouă și HgDouăClDouă sunt insolubile.
4- Majoritatea sărurilor de argint sunt insolubile. AgNO3 și Ag (CDouăH3SAUDouă) sunt săruri solubile comune de argint; Practic, toate celelalte sunt insolubile.
5- Majoritatea sărurilor sulfatate sunt solubile. Excepții importante de la această regulă includ CaSO4, Baso4, PbSO4, AgDouăSO4 și SrSO4.
6- Majoritatea sărurilor de hidroxid sunt doar puțin solubile. Sărurile de hidroxid ale elementelor din grupa I sunt solubile. Sărurile de hidroxid ale elementelor din grupa II (Ca, Sr și Ba) sunt ușor solubile.
Sărurile de hidroxid ale metalelor de tranziție și Al3 + sunt insolubile. Astfel, Fe (OH)3, Al (OH)3, Co (OH)Două nu sunt solubile.
7- Majoritatea sulfurilor metalelor de tranziție sunt extrem de insolubile, inclusiv CdS, FeS, ZnS și AgDouăS. Arsenicul, antimoniul, bismutul și sulfurile de plumb sunt, de asemenea, insolubile.
8- Carbonatii sunt frecvent insolubili. Carbonati din grupa II (CaCO3, SrCO3 și BaCO3) sunt insolubile, la fel ca FeCO3 și PbCO3.
9- Cromatii sunt adesea insolubili. Exemplele includ PbCrO4 și BaCrO4.
10- Fosfați precum Ca3(PO4)Două și Ag3PO4 sunt frecvent insolubile.
11- Fluoruri precum BaFDouă, MgFDouă și PbFDouă sunt frecvent insolubile.
Exemple de solubilitate în soluții apoase
Cola, apă sărată, ploaie, soluții acide, soluții de bază și soluții sărate sunt exemple de soluții apoase. Când aveți o soluție apoasă, puteți induce un precipitat prin reacții de precipitare.
Reacțiile de precipitații sunt uneori numite reacții de „dublă deplasare”. Pentru a determina dacă se va forma un precipitat atunci când se amestecă soluții apoase de doi compuși:
- Înregistrați toți ionii în soluție.
- Combinați-i (cation și anion) pentru a obține toate precipitațiile potențiale.
- Utilizați regulile de solubilitate pentru a determina care (dacă există) combinație (combinații) este insolubilă și va precipita.
Exemplul 1: Ce se întâmplă când Ba (NO3)Două (aq) și NaDouăCO3 (aq)?
Ioni prezenți în soluție: BaDouă+, NU3-, N / A+, CO3Două-
Potențial precipitat: BaCO3, NaNO3
Reguli de solubilitate: BaCO3 este insolubil (regula 5), NaNO3 este solubil (regula 1).
Ecuație chimică completă:
Baie3)Două(aq) + NaDouăCO3(aq) ”BaCO3(s) + 2NaNO3 (aq)
Ecuația ionică netă:
BaDouă+(aq) + CO3Două-(aq) ”BaCO3 (e)
Exemplul 2: Ce se întâmplă când Pb (NO3)Două (aq) și NH4Eu (aq)?
Ioni prezenți în soluție: PbDouă+, NU3-, NH4+, Eu-
Potențial precipitat: PbIDouă, NH4NU3
Reguli de solubilitate: PbIDouă este insolubil (regula 3), NH4NU3 este solubil (regula 1).
Ecuație chimică completă: Pb (NO3)2 (aq) + 2NH4Eu(aq) ”PbI2 (e) + 2NH4NU3 (aq)
Ecuație ionică netă: PbDouă+(aq) + 2I-(aq) ”PbI2 (e).
Referințe
- Anne Marie Helmenstine. (2017, 10 mai). Definiție apoasă (soluție apoasă). Recuperat de la thoughtco.com.
- Anne Marie Helmenstine. (2017, 14 mai). Definirea soluției apoase în chimie. Recuperat de la thoughtco.com.
- Antoinette Mursa, K. W. (2017, 14 mai). Reguli de solubilitate. Recuperat de la chem.libretexts.org.
- Soluții apoase. (S.F.). Recuperat de la saylordotorg.github.io.
- Berkey, M. (2011, 11 noiembrie). Soluții apoase: definiție și exemple. Recuperat de pe youtube.com.
- Reacții în soluție apoasă. (S.F.). Recuperat de la chemistry.bd.psu.edu.
- Reid, D. (S.F.). Soluție apoasă: definiție, reacție și exemplu. Recuperat de la study.com.
- Solubilitate. (S.F.). Recuperat de la chemed.chem.purdue.edu.



Nimeni nu a comentat acest articol încă.