
Ce sunt subnivelele energetice și cum sunt ele reprezentate?

subnivelele energetice în atom sunt modul în care electronii sunt organizați în cochiliile electronice, distribuția lor în moleculă sau atom. Aceste subnivele energetice se numesc orbitali..
Organizarea electronilor în subnivele este ceea ce permite combinațiile chimice ale diferiților atomi și definește, de asemenea, poziția lor în Tabelul periodic al elementelor..
Electronii sunt aranjați în cochiliile electronice ale atomului într-un anumit mod printr-o combinație de stări cuantice. În momentul în care una dintre aceste stări este ocupată de un electron, ceilalți electroni trebuie să fie localizați într-o stare diferită.
Indice articol
- 1. Introducere
- 2 Amplasarea în tabelul periodic al elementelor
- 3 Amplasarea electronului în orbitali
- 4 configurații electronice speciale
- 5 Referințe
Introducere
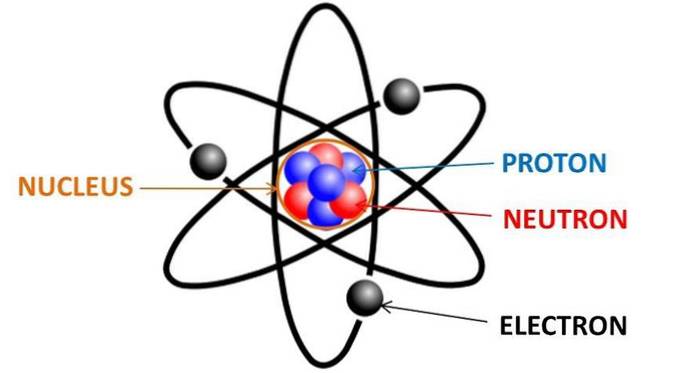
Fiecare element chimic din tabelul periodic este format din atomi, care la rândul lor sunt alcătuite din neutroni, protoni și electroni. Electronii sunt particule încărcate negativ care se găsesc în jurul nucleului oricărui atom, distribuite în orbitalele electronilor.
Orbitalii electronilor sunt volumul de spațiu în care un electron are șanse de 95% să se întâlnească. Există diferite tipuri de orbitali, cu forme diferite. În fiecare orbital pot fi localizați maximum doi electroni. Primul orbital al unui atom este locul în care există cea mai mare probabilitate de a găsi electroni.
Orbitalii sunt desemnați prin literele s, p, d și f, adică Sharp, Principiu, Difuz și Fundamental și se combină atunci când atomii se unesc pentru a forma o moleculă mai mare. În fiecare strat al atomului se află aceste combinații de orbitali.
De exemplu, în stratul 1 al atomului există orbitalii S, în stratul 2 sunt orbitali S și P, în stratul 3 al atomului sunt orbitali S, P și D și în cele din urmă în stratul 4 al atomului sunt toți orbitalele S, P, D și F.
De asemenea, în orbitali găsim subnivele diferite, care la rândul lor pot stoca mai mulți electroni. Orbitalii la niveluri diferite de energie sunt similare, dar ocupă zone diferite în spațiu..
Primul orbital și al doilea orbital au aceleași caracteristici ca un orbital S, au noduri radiale, au o probabilitate mai mare de volum sferic și pot deține doar doi electroni. Cu toate acestea, acestea sunt situate la niveluri diferite de energie și ocupă astfel spații diferite în jurul nucleului..
Amplasarea pe tabelul periodic al elementelor
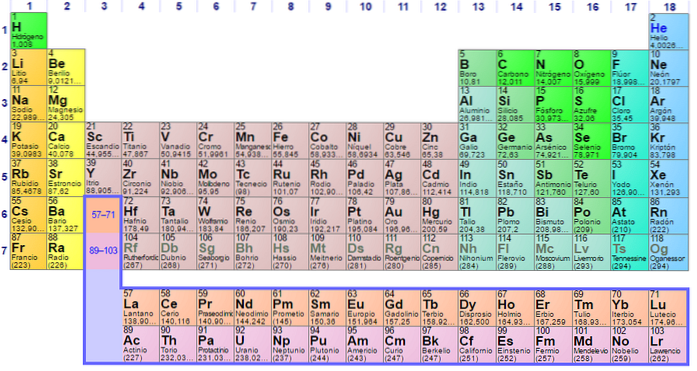
Fiecare dintre configurațiile electronice ale elementelor sunt unice, motiv pentru care își determină poziția în tabelul periodic al elementelor. Această poziție este definită de perioada fiecărui element și de numărul său atomic de numărul de electroni pe care îl are atomul elementului..
Astfel, folosirea tabelului periodic pentru a determina configurația electronilor în atomi este esențială. Elementele sunt împărțite în grupuri conform configurațiilor lor electronice după cum urmează:
Fiecare orbital este reprezentat în blocuri specifice în cadrul tabelului periodic al elementelor. De exemplu, blocul orbitalilor S este regiunea metalelor alcaline, primul grup din tabel și unde se găsesc șase elemente Litiu (Li), Rubidiu (Rb), Potasiu (K), Sodiu (Na), Franciu ( Fr) și cesiu (Cs) și, de asemenea, hidrogen (H), care nu este un metal, ci un gaz.
Acest grup de elemente au un electron, care se pierde ușor pentru a forma un ion încărcat pozitiv. Sunt cele mai active metale și cele mai reactive.
Hidrogenul, în acest caz, este un gaz, dar se află în grupul 1 din tabelul periodic al elementelor, deoarece are și un singur electron. Hidrogenul poate forma ioni cu o singură sarcină pozitivă, dar scoaterea electronului său unic necesită mult mai multă energie decât îndepărtarea electronilor din celelalte metale alcaline. La formarea compușilor, hidrogenul generează de obicei legături covalente.
Cu toate acestea, sub presiuni extrem de ridicate, hidrogenul devine metalic și se comportă ca restul elementelor din grupul său. Acest lucru se întâmplă, de exemplu, în interiorul nucleului planetei Jupiter.
Grupa 2 corespunde metalelor alcalino-pământoase, deoarece oxizii lor au proprietăți alcaline. Printre elementele acestui grup găsim magneziu (Mg) și calciu (Ca). Orbitalele lor aparțin și nivelului S..
Metalele de tranziție, care corespund grupurilor 3-12 din tabelul periodic, au orbital de tip D..
Elementele care merg de la grupul 13 la 18 din tabel corespund orbitalelor P. Și în cele din urmă elementele cunoscute sub numele de lantanide și actinide au orbitalele numite F.
Localizarea electronilor pe orbitali
Electronii se găsesc în orbitalele atomului ca o modalitate de scădere a energiei. Prin urmare, dacă încearcă să crească energia, electronii vor umple principalele niveluri orbitale, îndepărtându-se de nucleul atomului..
Trebuie avut în vedere că electronii au o proprietate intrinsecă cunoscută sub numele de spin. Acesta este un concept cuantic care determină, printre altele, rotirea electronului în orbital. Ce este esențial pentru a vă determina poziția în subnivelele energetice.
Regulile care determină poziția electronilor în orbitalele atomului sunt următoarele:
- Principiul lui Aufbau: Electronii intră mai întâi pe orbitalii cu cea mai mică energie. Acest principiu se bazează pe diagrame ale nivelurilor de energie ale anumitor atomi.
- Principiul de excludere Pauli: Un orbital atomic poate descrie cel puțin doi electroni. Aceasta înseamnă că doar doi electroni cu spin diferit de electroni pot ocupa un orbital atomic..
Aceasta implică faptul că un orbital atomic este o stare energetică.
- Regula lui Hund: Atunci când electronii ocupă orbitali de aceeași energie, electronii vor intra în primii orbitali goi. Aceasta înseamnă că electronii preferă rotiri paralele pe orbite separate ale subnivelelor energetice..
Electronii vor umple toți orbitalii din subniveluri înainte de a întâlni rotiri opuse.
Configurații electronice speciale
Există, de asemenea, atomi cu cazuri speciale de subnivele de energie. Când doi electroni ocupă același orbital, nu numai că trebuie să aibă rotiri diferite (așa cum este indicat de principiul de excludere Pauli), dar cuplarea electronilor crește ușor energia..
În cazul subnivelelor energetice, jumătate plină și subnivel complet complet reduc energia atomului. Acest lucru duce atomul la o stabilitate mai mare.
Referințe
- Configuratie electronica. Recuperat de pe Wikipedia.com.
- Introducere configurații electronice. Recuperat de la chem.libretexts.org.
- Orbitali și obligațiuni. Recuperat de la chem.fsu.edu.
- Tabel periodic, elemente principale ale grupului. Recuperat de la newworldencyclopedia.org.
- Principiile de configurație electro. Recuperat de la sartep.com.
- Configurarea electronică a elementelor. Recuperat de la science.uwaterloo.ca.
- Rotire electronică. Recuperat de la hyperphysics.phy-astr.gsu.edu.



Nimeni nu a comentat acest articol încă.