
Procedura de electroliză a apei, tehnici, la ce servește
electroliza apei Este descompunerea apei în componentele sale elementare prin aplicarea unui curent electric. Când procedăm, hidrogen și oxigen molecular, HDouă pe mineDouă. Aceste două suprafețe sunt mai cunoscute sub numele de electrozi..
Teoretic, volumul de HDouă format trebuie să fie de două ori volumul de ODouă. De ce? Deoarece molecula de apă are un raport H / O egal cu 2, adică doi H pentru fiecare oxigen. Această relație este verificată direct cu formula sa chimică, HDouăO. Cu toate acestea, mulți factori experimentali influențează volumele obținute.

Dacă electroliza se efectuează în interiorul unor tuburi scufundate în apă (imaginea superioară), coloana inferioară de apă corespunde hidrogenului, deoarece există o cantitate mai mare de gaz care exercită presiune pe suprafața lichidului. Bulele înconjoară electrozii și ajung să crească după depășirea presiunii de vapori a apei.
Rețineți că tuburile sunt separate unele de altele în așa fel încât să existe o migrație redusă a gazului de la un electrod la altul. La scări mici, acest lucru nu reprezintă un risc iminent; dar pe scări industriale, amestecul gazos de HDouă pe mineDouă este extrem de periculos și exploziv.
Din acest motiv, celulele electrochimice în care se efectuează electroliza apei sunt foarte scumpe; Au nevoie de un design și elemente care să asigure că gazele nu se amestecă niciodată, o sursă de alimentare rentabilă, concentrații mari de electroliți, electrozi speciali (electrocatalizatori) și mecanisme de stocare a HDouă produs.
Electrocatalizatorii reprezintă frecare și, în același timp, aripi pentru rentabilitatea electrolizei apei. Unele constau din oxizi de metale nobile, precum platina și iridiul, ale căror prețuri sunt foarte mari. În acest moment, în special, cercetătorii își unesc forțele pentru a proiecta electrozi eficienți, stabili și ieftini..
Motivul acestor eforturi este accelerarea formării lui ODouă, care apare la viteze mai mici comparativ cu HDouă. Aceasta încetinește de electrodul în care se formează ODouă aduce ca o consecință generală aplicarea unui potențial mult mai mare decât este necesar (overpotential); ceea ce este același, la o performanță mai mică și cheltuieli mai mari.
Indice articol
- 1 Reacție de electroliză
- 1.1 Reacții semicelulare
- 2 Procedură
- 3 Tehnici
- 3.1 Electroliza cu apă alcalină
- 3.2 Electroliza cu membrană electrolitică polimerică
- 3.3 Electroliza cu oxizi solizi
- 4 Pentru ce este electroliza apei?
- 4.1 Producția de hidrogen și utilizările sale
- 4.2 Ca metodă de depanare
- 4.3 Ca aport de oxigen
- 5 Experiment la domiciliu
- 5.1 Variabile de acasă
- 6 Referințe
Reacție de electroliză
Electroliza apei implică multe aspecte complexe. Cu toate acestea, în termeni generali, baza sa se bazează pe o reacție globală simplă:
2HDouăO (l) => 2HDouă(g) + ODouă(g)
După cum se poate observa din ecuație, sunt implicate două molecule de apă: una trebuie să fie în mod obișnuit redusă sau să câștige electroni, în timp ce cealaltă trebuie să se oxideze sau să piardă electroni..
HDouă Este un produs al reducerii apei, deoarece câștigul de electroni promovează că protonii H+ se poate lega covalent, iar oxigenul este transformat în OH-. Prin urmare, HDouă apare la catod, care este electrodul în care are loc reducerea.
În timp ce ODouă provine din oxidarea apei, datorită căreia pierde electronii care îi permit să se lege de hidrogen și, în consecință, eliberează protoni H+. ODouă este produs la anod, electrodul în care are loc oxidarea; și spre deosebire de celălalt electrod, pH-ul din jurul anodului este acid și nu bazic.
Reacții semicelulare
Acest lucru poate fi rezumat cu următoarele ecuații chimice pentru reacțiile semicelulare:
2HDouăO + 2e- => HDouă + 2OH- (Catod, de bază)
2HDouăO => ODouă + 4H+ + 4e- (Anod, acid)
Cu toate acestea, apa nu mai poate pierde electroni (4e-) din care cealaltă moleculă de apă câștigă la catod (2e-); prin urmare, prima ecuație trebuie să fie înmulțită cu 2 și apoi scăzută cu a doua ecuație pentru a obține ecuația netă:
2 (2HDouăO + 2e- => HDouă + 2OH-)
2HDouăO => ODouă + 4H+ + 4e-
6HDouăO => 2HDouă + SAUDouă + 4H+ + 4OH-
Dar 4H+ și 4OH- forma 4HDouăSau, astfel, acestea elimină patru din cele șase molecule de HDouăSau lăsând două; iar rezultatul este reacția globală tocmai ridicată.
Reacțiile semicelulare se modifică cu valorile pH-ului, tehnicile și, de asemenea, au potențiale de reducere sau oxidare asociate, care determină cât de mult curent trebuie furnizat pentru ca electroliza apei să se desfășoare spontan..
Proces
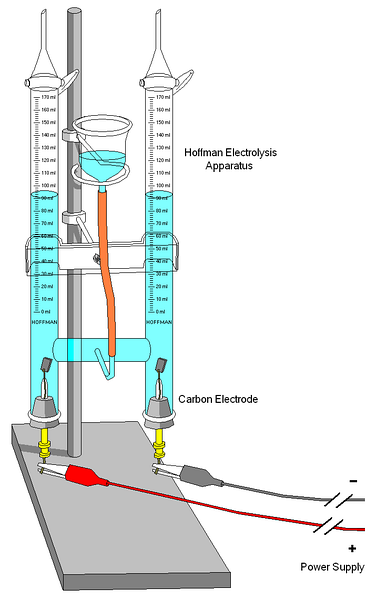
Un voltmetru Hoffman este prezentat în imaginea de mai sus. Cilindrii sunt umpluți cu apă și electroliții selectați prin duza din mijloc. Rolul acestor electroliți este de a crește conductivitatea apei, deoarece în condiții normale există foarte puțini ioni H3SAU+ și OH- produse ale autoionizării sale.
Cei doi electrozi sunt de obicei platină, deși în imagine au fost înlocuiți cu electrozi de carbon. Ambele sunt conectate la o baterie, cu care se aplică o diferență de potențial (ΔV) care favorizează oxidarea apei (formarea de ODouă).
Electronii parcurg întregul circuit până când ajung la celălalt electrod, unde apa îi cucerește și devine HDouă și OH-. În acest moment anodul și catodul sunt deja definite, care pot fi diferențiate de înălțimea coloanelor de apă; cea cu cea mai mică înălțime, corespunde catodului, unde se formează HDouă.
În partea de sus a cilindrilor, există chei care permit eliberarea gazelor generate. Prezența H poate fi verificată cu atențieDouă făcându-l să reacționeze cu o flacără, a cărei combustie produce apă gazoasă.
Tehnici
Tehnicile de electroliză a apei variază în funcție de cantitatea de HDouă pe mineDouă care se propune a genera. Ambele gaze sunt foarte periculoase dacă sunt amestecate împreună, motiv pentru care celulele electrolitice implică modele complexe pentru a minimiza creșterea presiunilor gazoase și difuzarea lor prin mediul apos..
La fel, tehnicile variază în funcție de celulă, de electrolitul adăugat în apă și de electrozii înșiși. Pe de altă parte, unele implică faptul că reacția se desfășoară la temperaturi mai ridicate, reducând consumul de energie electrică, iar altele folosesc presiuni enorme pentru a menține HDouă stocat.
Dintre toate tehnicile, pot fi menționate următoarele trei:
Electroliza cu apă alcalină
Electroliza se efectuează cu soluții de bază ale metalelor alcaline (KOH sau NaOH). Cu această tehnică apar reacțiile:
4HDouăO (l) + 4e- => 2HDouă(g) + 4OH-(ac)
4OH-(ac) => ODouă(g) + 2HDouăO (l) + 4e-
După cum se poate observa, atât la catod cât și la anod, apa are un pH de bază; și în plus, OH- migrează către anod unde se oxidează la ODouă.
Electroliza cu membrană electrolitică polimerică
Această tehnică folosește un polimer solid care servește ca membrană permeabilă pentru H+, dar impermeabil la gaze. Acest lucru asigură o siguranță mai mare în timpul electrolizei..
Reacțiile semicelulare pentru acest caz sunt:
4H+(ac) + 4e- => 2HDouă(g)
2HDouăO (l) => ODouă(g) + 4H+(ac) + 4e-
H ionii+ migrează de la anod la catod, unde sunt reduse pentru a deveni HDouă.
Electroliza cu oxizi solizi
Foarte diferit de alte tehnici, acesta folosește oxizi ca electroliți, care la temperaturi ridicate (600-900ºC) funcționează ca mijloc de transport al anionului ODouă-.
Reacțiile sunt:
2HDouăO (g) + 4e- => 2HDouă(g) + 2ODouă-
2ODouă- => ODouă(g) + 4e-
Rețineți că de data aceasta sunt anioni oxizi, ODouă-, cele care călătoresc la anod.
La ce servește electroliza apei?
Electroliza apei produce HDouă (g) și ODouă (g). Aproximativ 5% din hidrogenul gazos produs în lume se produce prin electroliza apei.
HDouă este un produs secundar al electrolizei soluțiilor apoase de NaCl. Prezența sării facilitează electroliza prin creșterea conductivității electrice a apei.
Reacția generală care are loc este:
2NaCI + 2HDouăO => ClDouă + HDouă + 2NaOH
Pentru a înțelege importanța enormă a acestei reacții, vor fi menționate unele dintre utilizările produselor gazoase; Pentru că la sfârșitul zilei, acestea sunt cele care determină dezvoltarea de noi metode pentru a realiza electroliza apei într-un mod mai eficient și mai verde.
Dintre toate, cel mai dorit este să funcționeze ca celule care înlocuiesc energetic utilizarea combustibililor fosili arși..
Producția de hidrogen și utilizările sale
-Hidrogenul produs în electroliză poate fi utilizat în industria chimică care acționează în reacții de dependență, în procese de hidrogenare sau ca agent de reducere în procesele de reducere.
-De asemenea, este esențial în unele acțiuni de importanță comercială, cum ar fi: producerea de acid clorhidric, peroxid de hidrogen, hidroxilamine etc. Este implicat în sinteza amoniacului printr-o reacție catalitică cu azotul.
-În combinație cu oxigenul, produce flăcări cu un conținut caloric ridicat, cu temperaturi cuprinse între 3.000 și 3.500 K. Aceste temperaturi pot fi utilizate pentru tăiere și sudare în industria metalelor, pentru creșterea cristalelor sintetice, producerea de cuarț etc..
-Tratarea apei: conținutul excesiv de mare de nitrați din apă poate fi redus prin eliminarea sa în bioreactoare, în care bacteriile folosesc hidrogenul ca sursă de energie
-Hidrogenul este implicat în sinteza materialelor plastice, poliesterului și nailonului. În plus, face parte din producția de sticlă, crescând arderea în timpul coacerii..
-Reacționează cu oxizii și clorura multor metale, inclusiv: argint, cupru, plumb, bismut și mercur pentru a produce metale pure.
-În plus, este utilizat ca combustibil în analiza cromatografică cu un detector de flacără..
Ca metodă de depanare
Electroliza soluțiilor de clorură de sodiu este utilizată pentru purificarea apei de la piscină. În timpul electrolizei, hidrogenul este produs la catod și clor (ClDouă) la anod. În acest caz, electroliza este denumită clorină de sare.
Clorul se dizolvă în apă pentru a forma acid hipocloros și hipoclorit de sodiu. Acidul hipocloros și hipocloritul de sodiu sterilizează apa.
Ca aport de oxigen
Electroliza apei este, de asemenea, utilizată pentru a genera oxigen pe Stația Spațială Internațională, care servește la menținerea unei atmosfere de oxigen în stație..
Hidrogenul poate fi utilizat într-o celulă de combustibil, o metodă de stocare a energiei și utilizarea apei generate în celulă pentru consumul astronauților.
Experiment la domiciliu
Experimentele de electroliză a apei au fost efectuate la scări de laborator cu voltmetre Hoffman sau cu un alt ansamblu care permite să conțină toate elementele necesare unei celule electrochimice..
Dintre toate ansamblurile și echipamentele posibile, cel mai simplu poate fi un recipient mare de apă transparent, care va servi drept celulă. În plus, orice suprafață metalică sau electrică trebuie să fie la îndemână pentru a funcționa ca electrozi; unul pentru catod și celălalt pentru anod.
În acest scop, chiar și creioane cu vârfuri ascuțite de grafit la ambele capete pot fi utile. Și, în sfârșit, o baterie mică și câteva cabluri care o conectează la electrozii improvizați..
Dacă nu se efectuează într-un recipient transparent, formarea bulelor gazoase nu ar fi apreciată..
Variabile de acasă
Deși electroliza apei este un subiect care conține multe aspecte interesante și pline de speranță pentru cei care caută surse alternative de energie, experimentul la domiciliu poate fi plictisitor pentru copii și alți spectatori..
Prin urmare, se poate aplica o tensiune suficientă pentru a genera formarea lui HDouă pe mineDouă alternând anumite variabile și notând modificările.
Prima dintre acestea este variația pH-ului apei, folosind fie oțet pentru a acidifica apa, fie NaDouăCO3 pentru a-l fundamenta ușor. Trebuie să apară o modificare a numărului de bule observate.
În plus, același experiment ar putea fi repetat cu apă caldă și rece. În acest fel, efectul temperaturii asupra reacției ar fi apoi luat în considerare..
În cele din urmă, pentru a face colectarea datelor puțin mai puțin incoloră, se poate folosi o soluție foarte diluată de suc de varză purpurie. Acest suc este un indicator acid-bazic de origine naturală.
Adăugându-l în recipient cu electrozii introduși, se va observa că la anod apa va deveni roz (acid), în timp ce la catod, culoarea va fi galbenă (bazică).
Referințe
- Wikipedia. (2018). Electroliza apei. Recuperat de pe: en.wikipedia.org
- Chaplin M. (16 noiembrie 2018). Electroliza apei. Structura apei și știința. Recuperat de la: 1.lsbu.ac.uk
- Eficiență energetică și energie regenerabilă. (s.f.). Producția de hidrogen: electroliză. Recuperat de la: energy.gov
- Phys.org. (14 februarie 2018). Catalizator cu eficiență ridicată și costuri reduse pentru electroliza apei. Recuperat de pe: phys.org
- Chimie LibreTexte. (18 iunie 2015). Electroliza apei. Recuperat de pe: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. și S. Lewis N. (2016). Principii și implementări ale sistemelor de electroliză pentru divizarea apei. Societatea Regală de Chimie.
- Regenții Universității din Minnesota. (2018). Electroliza apei 2. Universitatea din Minnesota. Recuperat de la: chem.umn.edu


Nimeni nu a comentat acest articol încă.