
Reacții simple și duble de deplasare și exemple
reacții de deplasare sunt toate acelea în care o specie chimică deplasează alta pe un compus. Această deplasare poate fi simplă sau dublă, diferind prin faptul că în primul este un element care este deplasat, în timp ce în al doilea se produce o schimbare de „perechi” între doi compuși..
Aceste tipuri de reacții sunt posibile numai în anumite condiții: una dintre specii trebuie să aibă un număr de oxidare zero sau toate trebuie neapărat ionizate. Ce înseamnă un număr de oxidare zero? Înseamnă că specia se află în starea sa naturală.

Un exemplu foarte ilustrativ al abordării de mai sus este reacția dintre un fir de cupru și o soluție de azotat de argint. Deoarece cuprul este un metal în starea sa naturală, atunci numărul său de oxidare este zero; pe de altă parte, cea a argintului este +1 (Ag+), care se dizolvă împreună cu ioni de azotat (NO3-).
Metalele renunță la electroni, dar unele sunt mai active decât altele; Aceasta înseamnă că nu toate metalele ruginesc atât de ușor. Deoarece cuprul este mai activ decât argintul, își donează electronii, reducându-l la starea sa naturală, reflectată ca o suprafață de argint care acoperă firul de cupru (imaginea de mai sus).
Indice articol
- 1 Reacții de deplasare
- 1.1 Simplu
- 1.2 Dublu
- 2 Exemple
- 2.1 Simplu
- 2.2 Dublu
- 3 Referințe
Reacții de deplasare
Simplu
Deplasarea hidrogenului și a metalelor
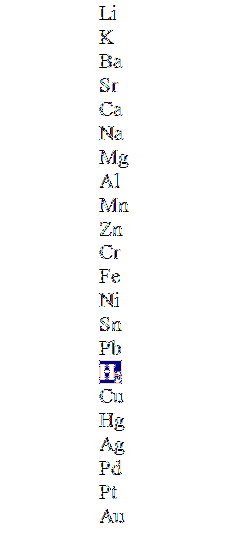
Imaginea superioară arată o coloană în ordinea descrescătoare a activității, evidențiind molecula de hidrogen. Acele metale care se află deasupra acestuia îl pot deplasa în acizi neoxidanți (HCI, HF, HDouăSW4, etc.), iar cei de mai jos nu vor reacționa deloc.
Reacția de deplasare simplă poate fi descrisă prin următoarea ecuație generală:
A + BC => AB + C
A deplasează C, care poate fi molecula HDouă sau alt metal. Da HDouă se formează prin reducerea ionilor H+ (2H+ + 2e- => HDouă), atunci specia A trebuie - datorită conservării masei și a energiei - să furnizeze electronii: acesta trebuie oxidat.
Pe de altă parte, dacă A și C sunt specii metalice, dar C este sub formă ionică (M+) și A în starea sa naturală, atunci reacția de deplasare va avea loc numai dacă A este mai activ decât C, obligându-l pe acesta din urmă să accepte electroni pentru a se reduce la starea sa metalică (M).
Deplasarea cu halogeni
În același mod, halogenii (F, Cl, Br, I, At) se pot mișca între ei, dar urmând o altă serie de activități. Pentru acestea, activitatea scade pe măsură ce se coboară prin grupa 7A (sau 17): I De exemplu, următoarea reacție are loc în mod natural: FDouă(g) + 2NaI (ac) => 2NaF (ac) + IDouă(s) Cu toate acestea, celălalt nu produce produse din motivele explicate: EuDouă(s) + NaF (ac) => X În ecuația de mai sus X înseamnă că nu există nicio reacție. Cu aceste cunoștințe se poate prezice ce amestec de săruri de halogen cu elementele pure produce produse. De regulă, iodul (un solid violet volatil) nu deplasează niciunul dintre ceilalți halogeni, dar ceilalți îl înlocuiesc atunci când se află în formă ionică (Na+ Eu-). Reacția de dublă deplasare, cunoscută și sub numele de reacție de metateză, este reprezentată după cum urmează: AB + CD => AD + CB De această dată, nu numai A deplasează C, ci și B deplasează D. Acest tip de deplasare are loc numai atunci când soluțiile de săruri solubile sunt amestecate și se formează un precipitat; adică AD sau CB trebuie să fie insolubile și să aibă interacțiuni electrostatice puternice. De exemplu, atunci când amestecați soluții KBr și AgNO3, cei patru ioni se deplasează prin mediu până când formează perechile corespunzătoare ale ecuației: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(ac) Ag ionii+ și fr- formează precipitatul de bromură de argint, în timp ce K+ si nu3- nu poate fi aranjat pentru a forma un cristal de nitrat de potasiu. Când un acid este neutralizat cu o bază, are loc o reacție de dublă deplasare: HCI (aq) + NaOH (aq) => NaCI (aq) + HDouăO (l) Aici nu se formează precipitate, deoarece clorura de sodiu este o sare foarte solubilă în apă, dar are loc o modificare a pH-ului, care se ajustează la o valoare apropiată de 7. Cu toate acestea, în următoarea reacție, o modificare a pH-ului și formarea unui precipitat au loc simultan: H3PO4(ac) + 3Ca (OH)Două => Ca3(PO4)Două(s) + 3HDouăO (l) Fosfatul de calciu este insolubil, precipitând ca un solid alb, în timp ce acidul fosforic este neutralizat cu hidroxid de calciu. Cu (s) + 2AgNO3(ac) => Cu (NO3)Două(ac) + 2Ag (s) Aceasta este reacția de imagine a firului de cupru. Dacă te uiți la seria activităților chimice pentru metale, vei descoperi că cuprul este peste argint, deci îl poate înlocui. Zn (s) + CuSO4(ac) => ZnSO4(ac) + Cu (s) Cu această altă reacție, apare opusul: acum soluția albăstruie de CuSO4 devine transparent pe măsură ce cuprul precipită ca metal și în același timp zincul metalic se dezintegrează în sare solubilă de sulf de zinc. 2Al (s) + 3NiBrDouă(ac) => 2AlBr3(ac) + 3Ni (s) Din nou, această reacție apare deoarece aluminiul este peste nichel în seria activităților chimice. Sn (s) + HDouăSW4(ac) => SnSO4(ac) + HDouă(g) Aici staniu deplasează hidrogenul, deși este foarte aproape de el în serie. 2K (s) + 2HDouăO (l) => 2KOH (aq) + HDouă(g) În cele din urmă, acele metale care se află în partea cea mai înaltă a seriei sunt atât de reactive încât deplasează chiar și hidrogenul din moleculele de apă, generând o reacție foarte exotermă (și explozivă).. Zn (NR3)Două(aq) + 2NaOH (aq) => Zn (OH)Două(s) + 2NaNO3(ac) Deși baza nu neutralizează acizi, ionii OH- simțiți mai multă afinitate pentru ZnDouă+ că ionii NU sunt3-; din acest motiv apare dubla deplasare. Timbru3)Două(ac) + NaDouăS (ac) => CuS (s) + 2NaNO3(ac) Această reacție este foarte asemănătoare cu cea precedentă, cu diferența că ambii compuși sunt săruri dizolvate în apă..Dubla
Reacție de neutralizare acido-bazică
Exemple
Simplu
Dubla
Referințe

Nimeni nu a comentat acest articol încă.