
Reducerea (chimia) din ce constă și exemple

reducere Este toată acea reacție chimică în care atomii unuia dintre reactanți ajung să câștige electroni; Ce se poate vedea și în acest fel: postul vacant sau „disconfortul” dvs. electronic este redus. Un atom câștigă electroni când o specie îi donează; adică ruginește.
Acest tip de reacție nu se poate întâmpla de la sine: dacă o specie acceptă electronii, alta trebuie să renunțe în mod necesar la ei. Altfel, materia ar fi creată din nimic, reducând atomii după ce a câștigat electroni din vid. Prin urmare, este o jumătate de reacție redox (reducere / oxidare).
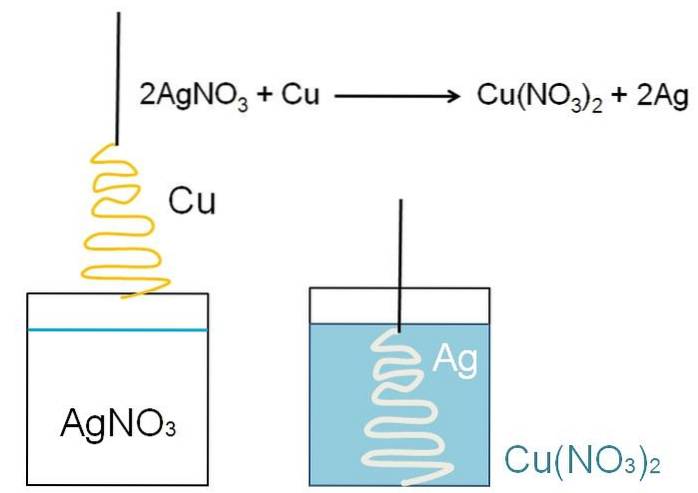
Un exemplu ilustrativ al reducerii care poate fi prezentat în sălile de clasă este reacția dintre o suprafață metalică de cupru și o soluție apoasă de azotat de argint, AgNO3.
În soluție, argintul se găsește ca cationi Ag+, incarcat pozitiv. Acestea, prin interacțiunea cu suprafața cuprului, în formă de pom de Crăciun, smulg electronii din atomii de cupru. Când se întâmplă acest lucru, cuprul înlocuiește argintul în sarea de nitrat; și, ca rezultat, azotat de cupru, Cu (NO3)Două.
Cu cationiDouă+ lângă NU3- transformați soluția în albăstrui; iar argintul, albeste bradul de parcă l-ar acoperi cu zăpadă.
Indice articol
- 1 Care este reducerea?
- 1.1 Numărul de oxigen
- 1.2 Atom electronegativ
- 2 Exemple
- 2.1 Reducerea chimiei organice
- 2.2 Extracția metalului
- 3 Referințe
Care este reducerea?
În reducere s-a spus deja că o specie câștigă electroni. Cum se poate verifica acest lucru într-o ecuație chimică? De exemplu, în ecuația pentru reacția dintre Cu și AgNO3, Cum se știe când are loc reducerea? Pentru a-l verifica, este necesar să se determine numărul sau starea de oxidare.
Elementele din stările lor naturale au, prin definiție, o stare de oxidare egală cu zero, deoarece se presupune că nu au pierdut și nici nu au câștigat electroni. Astfel, metalele solide au o stare de oxidare zero. Astfel, argintul merge de la +1 (Ag+) la 0 (Ag). Sarcina unui ion metalic este egală cu starea sa de oxidare.
Pe de altă parte, electronii provin din cupru: mergând de la 0 (Cu) la +2 (CuDouă+). Anion nitrat, NU3- rămâne neschimbată în timp ce ambele metale schimbă electroni; prin urmare, ecuația poate fi scrisă ca:
2Ag+ + Cu => 2Ag + CuDouă+
Observați că atât sarcinile, cât și atomii sunt echilibrate..
În aceasta constă reducerea chimică: în câștigul de electroni care fac stările de oxidare ale atomilor mai puțin pozitive decât cea a electronilor..
Numărul de oxigen
Oxigenii sunt atomi foarte electronegativi și oxidanți, deci atunci când un atom formează compuși cu ei (cum ar fi oxizii), aceștia au stări de oxidare pozitive. Cu cât numărul de oxigeni care interacționează cu atomul este mai mare, cu atât va fi mai pozitivă starea sa de oxidare; sau ceea ce este la fel, este mai ruginit.
Prin urmare, atunci când un compus are mai puțini atomi de oxigen, se spune că este mai puțin oxidat; adică atomul pierde mai puțini electroni.
Un exemplu clasic poate fi văzut în monoxidul de carbon și dioxidul de carbon. Pentru CO, carbonul are o stare de oxidare de +2; în timp ce pentru CODouă, starea sa de oxidare este +4.
Deci, dacă într-o reacție CODouă se transformă în CO, se spune că se produce o reducere; întrucât carbonul interacționează acum cu un oxigen și nu cu doi. Pentru reacția opusă, CO transformându-se în CODouă, se vorbește despre o oxidare a carbonului.
Acest lucru se aplică tuturor atomilor, în special metalelor din oxizii lor metalici; de exemplu, CrODouă (Cr4+) și CrO3 (Cr6+).
În ecuațiile chimice în care o specie pierde oxigen în timp ce cealaltă specie îl câștigă, se spune că are loc un transfer de oxigen.
Atom electronegativ
Puteți stabili întotdeauna dacă a existat o reducere prin schimbarea stării de oxidare la o valoare mai puțin pozitivă. Așa cum am explicat, o modalitate rapidă de a observa fără a face chiar calcule este observarea dacă există o scădere a atomilor de oxigen într-un compus..
La fel se poate întâmpla cu orice alt atom care este mai electronegativ decât atomul care câștigă sau pierde electroni.
De exemplu, dacă CF4 reacționează în așa fel încât să devină CH4, apoi se spune că a avut loc o reducere; întrucât fluorul este mult mai electronegativ decât atomul de hidrogen. Ca rezultat, carbonul este mai puțin oxidat în CH4 că în CF4, ceea ce este egal cu a spune că a fost redus.
Exemple
Reducerea chimiei organice
Exemplul CF4 și CH4 reflectă ceea ce se întâmplă în reacțiile organice, unde reducerea sarcinii parțiale a unui atom este considerată un câștig electronic. Acest lucru se aplică foarte mult atunci când se ia în considerare reducerea grupelor funcționale oxigenate..
De exemplu, luați în considerare grupurile ROH, RCHO și COOH. Primul corespunde alcoolilor, unde legăturile de carbon cu oxigenul (C-OH); a doua este gruparea aldehidă, în care carbonul formează o legătură dublă cu oxigenul și este legat de asemenea de hidrogen (C = O-H); iar al treilea este grupul carboxil.
În grupul carboxil, carbonul formează o legătură dublă cu un O și o legătură simplă cu un alt O (HO-C = O).
Prin urmare, o reducere apare dacă un acid carboxilic este transformat în alcool:
RCOOH => ROH
Extracția metalelor
Reducerea chimică este extrem de importantă în procesele de extragere a metalelor din mineralele lor. Unele dintre reacții sunt:
HgS + ODouă => Hg + SODouă
Sulfura de mercur este redusă la mercur metalic.
CuDouăS + ODouă => 2Cu + SODouă
Sulfura de cupru este redusă la cupru metalic.
2ZnS + 3ODouă => 2ZnO + 2SODouă
ZnO + C => Zn + CO (rețineți transferul lui O)
Sulfura de zinc este redusă mai întâi la monoxidul său și apoi la forma sa metalică.
CredinţăDouăSAU3 + 3CO => 2Fe + 3CODouă
Oxidul feric este redus la fier metalic.
WO3 + 3HDouă => L + 3HDouăSAU
Iar trioxidul de tungsten este redus la tungsten metalic.
Ca exercițiu, numărul de oxidare al metalului poate fi determinat înainte ca acesta să fie redus.
Referințe
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.
- Chimie LibreTexte. (9 decembrie 2018). Reacții de oxidare-reducere. Recuperat de pe: chem.libretexts.org
- Helmenstine, Anne Marie, dr. (04 iulie 2018). Definiția reducerii chimiei. Recuperat de pe: thoughtco.com
- Hultzman R. (2019). Reducerea chimiei: definiție și prezentare generală. Studiu. Recuperat de la: study.com
- Clark J. (2013). Definiții de oxidare și reducere (redox). Recuperat de pe: chemguide.co.uk
- Vizualizare Tutor. (s.f.). Reacție de reducere. Recuperat de pe: chemistry.tutorvista.com



Nimeni nu a comentat acest articol încă.