
Istoria rubidiului, proprietăți, structură, obținere, utilizări
rubidiu Este un element metalic care aparține grupei 1 a tabelului periodic: cel al metalelor alcaline, fiind reprezentat de simbolul chimic Rb. Numele său sună similar cu rubinul și se datorează faptului că atunci când a fost descoperit, spectrul său de emisie a arătat linii caracteristice de culoare roșu intens..
Este unul dintre cele mai reactive metale care există. Este primul dintre metalele alcaline care, deși nu este foarte dens, se scufundă în apă. De asemenea, reacționează cu el mai exploziv în comparație cu litiu, sodiu și potasiu. Au existat experimente în care veziculele izbucnesc acolo unde este stocat (imaginea de jos) pentru a cădea și a exploda în căzi.

Rubidiul se distinge prin faptul că este un metal mai scump decât aurul în sine; nu atât din cauza lipsei sale, ci din cauza distribuției sale largi mineralogice în scoarța terestră și a dificultăților care apar atunci când se izolează de compușii de potasiu și cesiu..
Prezintă o tendință clară de a se asocia cu potasiul din mineralele sale, fiind găsit ca impurități. Nu numai în materie geochimică formează un duo cu potasiu, ci și în domeniul biochimiei.
Organismul „confundă” ionii K+ de cei de la Rb+; cu toate acestea, rubidiul nu este un element esențial până în prezent, deoarece rolul său în metabolism este necunoscut. Chiar și așa, suplimentele de rubidiu au fost utilizate pentru a atenua anumite afecțiuni medicale, cum ar fi depresia și epilepsia. Pe de altă parte, ambii ioni degajă o flacără violetă la căldura brichetei.
Datorită costului său ridicat, aplicațiile sale nu se bazează prea mult pe sinteza catalizatorilor sau materialelor, ci ca o componentă pentru diverse dispozitive cu baze fizice teoretice. Unul dintre ele este ceasul atomic, celulele solare și magnetometrele. Acesta este motivul pentru care rubidiul este uneori considerat ca un metal subevaluat sau sub-studiat..
Indice articol
- 1 Istorie
- 2 Proprietăți fizice și chimice
- 2.1 Aspect
- 2.2 Număr atomic (Z)
- 2.3 Masa molară
- 2.4 Punct de topire
- 2.5 Punctul de fierbere
- 2.6 Densitate
- 2.7 Căldura de fuziune
- 2.8 Căldura de vaporizare
- 2.9 Electronegativitate
- 2.10 Afinitate electronică
- 2.11 Energiile de ionizare
- 2.12 Raza atomică
- 2.13 Conductivitatea termică
- 2.14 Rezistivitate electrică
- 2.15 Duritatea lui Mohs
- 2.16 Reactivitate
- 3 Structură și configurație electronică
- 3.1 numere de oxidare
- 3.2 Clustere
- 4 Unde se găsește și se obține
- 4.1 Scoarța terestră
- 4.2 Asocierea geochimică
- 4.3 Cristalizarea fracționată
- 4.4 Electroliză sau reducere
- 5 izotopi
- 6 Riscuri
- 6.1 Metal
- 6.2 Ioni
- 7 utilizări
- 7.1 Colector de gaze
- 7.2 Pirotehnica
- 7.3 Supliment
- 7.4 Condensat Bose-Einstein
- 7.5 Diagnosticul tumorilor
- 7.6 Componentă
- 7.7 Ceasuri atomice
- 8 Referințe
Poveste
Rubidiul a fost descoperit în 1861 de către chimiștii germani Robert Bunsen și Gustav Kirchhoff, folosind spectroscopia. Pentru a face acest lucru, au folosit arzătorul Bunsen și spectroscopul, inventat cu doi ani mai devreme, precum și tehnici analitice de precipitare. Obiectul său de studiu a fost lepidolitul mineral, a cărui probă a fost colectată din Saxonia, Germania.
Au început de la 150 kg de mineral de lepidolit, pe care l-au tratat cu acid cloroplatinic, HDouăPtCl6, pentru a precipita hexacloroplatinatul de potasiu, KDouăPtCl6. Cu toate acestea, când i-au studiat spectrul arzându-l în arzătorul Bunsen, și-au dat seama că prezentau linii de emisie care nu coincideau în acel moment cu niciun alt element..
Spectrul de emisie al acestui nou element este caracterizat prin faptul că are două linii bine definite în regiunea roșie. De aceea l-au botezat cu numele „rubidus” care înseamnă „roșu închis”. Mai târziu, Bunsen și Kirchhoff au reușit să separe RbDouăPtCl6 din KDouăPtCl6 prin cristalizare fracționată; pentru a o reduce în final la sarea sa de clorură folosind hidrogen.
Identificând și izolând o sare a noului element rubidiu, chimiștii germani au avut nevoie doar să o reducă la starea sa metalică. Pentru a realiza acest lucru, au încercat în două moduri: aplicarea electrolizei la clorura de rubidiu sau încălzirea unei sări mai ușor de redus, cum ar fi tartratul său. Astfel s-a născut rubidiul metalic.
Proprietati fizice si chimice
Aspect
Metal moale, gri-argintiu. Este atât de netedă încât arată ca untul. De obicei este ambalat în fiole de sticlă, în care predomină o atmosferă inertă care o protejează de reacția cu aerul..
Număr atomic (Z)
37
Masă molară
85,4678 g / mol
Punct de topire
39 ° C
Punct de fierbere
688 ºC
Densitate
La temperatura camerei: 1,532 g / cm3
La punctul de topire: 1,46 g / cm3
Densitatea rubidiului este mai mare decât cea a apei, deci se va scufunda în timp ce reacționează violent cu ea.
Căldura de fuziune
2,19 kJ / mol
Căldura de vaporizare
69 kJ / mol
Electronegativitate
0,82 pe scara Pauling
Afinitate electronică
46,9 kJ / mol
Energiile de ionizare
-Mai întâi: 403 kJ / mol (Rb+ gazos)
-În al doilea rând: 2632,1 kJ / mol (RbDouă+ gazos)
-În al treilea rând: 3859,4 kJ / mol (Rb3+ gazos)
Radio atomic
248 pm (empiric)
Conductivitate termică
58,2 W / (mK)
Rezistență electrică
128 nΩm la 20 ° C
Duritatea lui Mohs
0,3. Prin urmare, chiar și talcul este mai dur decât rubidiul metalic..
Reactivitate

Rubidiul este unul dintre cele mai reactive metale alcaline, după cesiu și franciu. De îndată ce este expus la aer, începe să ardă și, dacă este lovit, aruncă scântei ușoare. Dacă este încălzit, emite, de asemenea, o flacără violetă (imaginea de sus), care este un test pozitiv pentru ioni Rb.+.
Reacționează cu oxigenul pentru a forma un amestec de peroxizi (RbDouăSAUDouă) și superoxizi (RbODouă). Deși nu reacționează cu acizi și baze, reacționează violent cu apa, generând hidroxid de rubidiu și hidrogen gazos:
Rb (s) + HDouăO (l) => RbOH (aq) + HDouă(g)
Reacționează cu hidrogenul pentru a-și forma hidrura corespunzătoare:
Rb (s) + HDouă(g) => 2RbH (s)
Și, de asemenea, cu halogeni și sulf exploziv:
2Rb (s) + ClDouă(g) => RbCl (s)
2Rb (s) + S (l) => RbDouăH.H)
Deși rubidiul nu este considerat un element toxic, este potențial periculos și prezintă pericole de incendiu atunci când intră în contact cu apa și oxigenul..
Structura și configurația electronică
Atomii de rubidiu sunt dispuși în așa fel încât să stabilească un cristal cu o structură cubică centrată pe corp (bcc, pentru acronimul său în engleză body centered cubic). Această structură este caracteristică pentru metalele alcaline, care sunt ușoare și tind să plutească pe apă; cu excepția rubidiului în jos (cesiu și franciu).
În cristalele de rubidiu bcc, atomii lor de Rb interacționează între ei datorită legăturii metalice. Aceasta este guvernată de o „mare de electroni” de pe carcasa sa de valență, de pe orbitalul 5s în funcție de configurația sa electronică:
[Kr] 5s1
Toate orbitalele 5s cu electronul lor unic se suprapun în toate dimensiunile cristalelor de rubidiu metalice. Cu toate acestea, aceste interacțiuni sunt slabe, deoarece pe măsură ce se coboară prin grupul metalului alcalin, orbitalii devin mai difusi și, prin urmare, legătura metalică slăbește..
De aceea, punctul de topire al rubidiului este de 39 ° C. La fel, legătura sa metalică slabă explică moliciunea solidului său; atât de moale încât arată ca untul de argint.
Nu există suficiente informații bibliografice cu privire la comportamentul cristalelor sale sub presiune ridicată; dacă există faze mai dense cu proprietăți unice precum sodiul.
Numere de oxidare
Configurația sa electronică indică imediat că rubidiul tinde puternic să-și piardă singurul electron pentru a deveni izoelectronic față de gazul cripton nobil. Când o face, se formează cationul monovalent Rb+. Se spune apoi că în compușii săi are un număr de oxidare +1 când se presupune existența acestui cation.
Datorită tendinței de oxidare a rubidiului, se presupune că există ioni Rb+ în compușii săi este corect, ceea ce la rândul său indică caracterul ionic al acestor compuși.
În aproape toți compușii de rubidiu prezintă un număr de oxidare de +1. Exemple dintre acestea sunt următoarele:
-Clorură de rubidiu, RbCl (Rb+Cl-)
-Hidroxid de rubidiu, RbOH (Rb+ Oh-)
-Carbonat de rubidiu, RbDouăCO3 (RbDouă+CO3Două-)
-Monoxid de rubidiu, RbDouăO (RbDouă+SAUDouă-)
-Superoxid de rubidiu, RbODouă (Rb+SAUDouă-)
Deși foarte rar, rubidiul ar putea avea și un număr de oxidare negativ: -1 (Rb-). În acest caz, am vorbi despre o „rubididă” dacă ar forma un compus cu un element mai puțin electronegativ decât acesta sau dacă ar fi supus în condiții speciale și riguroase.
Clustere
Există compuși în care fiecare atom de Rb prezintă în mod individual numere de oxidare cu valori fracționare. De exemplu, în Rb6O (Rb6Două+SAUDouă-) și Rb9SAUDouă (Rb94+SAUDouăDouă-) sarcina pozitivă este distribuită între un set de atomi Rb (clustere). Astfel, în Rb6Sau numărul de oxidare în teorie ar fi +1/3; în timp ce în Rb9SAUDouă, + 0,444 (4/9).
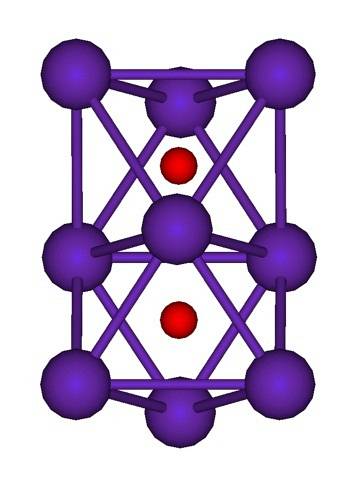
Structura cluster a Rb este prezentată mai sus.9SAUDouă reprezentată de un model de sfere și bare. Rețineți cum cei nouă atomi Rb „înglobează” anionii O.Două-.
Prin elucubrație, este ca și cum o parte din cristalele metalice originale de rubidiu au rămas neschimbate în timp ce erau separate de cristalul mamă. Ei pierd electroni în acest proces; cele necesare pentru a atrage ODouă-, iar sarcina pozitivă rezultată este distribuită între toți atomii grupului menționat (set sau agregate de atomi Rb).
Astfel, în aceste grupuri de rubidiu, existența Rb nu poate fi presupusă în mod formal.+. Rb6O și Rb9SAUDouă Acestea sunt clasificate ca suboxizi de rubidiu, în care se îndeplinește această aparentă anomalie de a avea un exces de atomi de metal în raport cu anionii de oxid.
Unde se găsește și se obține
scoarța terestră

Rubidiul este al 23-lea cel mai abundent element din scoarța terestră, cu o abundență comparabilă cu cea a metalelor zinc, plumb, cesiu și cupru. Detaliul este că ionii săi sunt răspândiți pe scară largă, deci nu predomină în niciun mineral ca element metalic principal, iar minereurile sale sunt, de asemenea, rare..
Din acest motiv, rubidiul este un metal foarte scump, chiar mai mult decât aurul în sine, deoarece procesul său de obținere din minereurile sale este complex din cauza dificultății de exploatare a acestuia..
În natură, având în vedere reactivitatea sa, rubidiul nu se găsește în starea sa nativă, ci ca oxid (RbDouăO), clorură (RbCl) sau însoțită de alți anioni. Ionii „liberi” Rb+ se găsesc în mările cu o concentrație de 125 µg / L, precum și în izvoarele termale și râurile.
Printre mineralele scoarței terestre care o conțin într-o concentrație mai mică de 1% avem:
-Leucite, K [AlSiDouăSAU6]
-Polucita, Cs (SiDouăBuna ziua6NHDouăSAU
-Carnalite, KMgCl36HDouăSAU
-Zinnwaldite, KLiFeAl (AlSi3)SAU10(OH, F)Două
-Amazonite, Pb, KAlSi3SAU8
-Petalite, LiAlSi4SAU10
-Biotit, K (Mg, Fe)3AlSi3SAU10(OH, F)Două
-Rubiclină, (Rb, K) AlSi3SAU8
-Lepidolit, K (Li, Al)3(Da, Al)4SAU10(F, OH)Două
Asociația Geochimică
Toate aceste minerale împărtășesc unul sau două lucruri în comun: sunt silicați de potasiu, cesiu sau litiu sau sunt săruri minerale ale acestor metale..
Aceasta înseamnă că rubidiul are o tendință puternică de asociere cu potasiu și cesiu; Poate chiar să înlocuiască potasiul în timpul cristalizării mineralelor sau rocilor, așa cum se întâmplă în depozitele de pegmatite atunci când magma cristalizează. Astfel, rubidiul este un produs secundar al exploatării și rafinării acestor roci și a mineralelor acestora..
Rubidiul poate fi, de asemenea, găsit în roci comune, cum ar fi granit, argile și bazalt, și chiar în depozite carbonifere. Dintre toate sursele naturale, lepidolitul reprezintă principalul său minereu și din care este exploatat comercial..
În carnalită, pe de altă parte, rubidiul poate fi găsit ca impurități RbCl cu un conținut de 0,035%. Și într-o concentrație mai mare există depozite de polucită și rubiclină, care pot avea până la 17% rubidiu..
Asocierea sa geochimică cu potasiul se datorează similarității razelor lor ionice; Rb+ este mai mare decât K+, dar diferența de dimensiuni nu este un impediment pentru ca primul să poată înlocui al doilea în cristalele sale minerale.
Cristalizarea fracționată
Fie că începeți cu lepidolit sau polucit, fie cu oricare dintre mineralele menționate mai sus, provocarea rămâne aceeași într-un grad mai mare sau mai mic: separați rubidiul de potasiu și cesiu; adică, aplicați tehnici de separare a amestecului care permit să aibă compuși sau săruri de rubidiu, pe de o parte, și pe cele de potasiu și cesiu, pe de altă parte..
Acest lucru este dificil, deoarece acești ioni (K+, Rb+ și Cs+) au o mare asemănare chimică; Reacționează în același mod pentru a forma aceleași săruri, care diferă cu greu între ele datorită densităților și solubilităților lor. De aceea se folosește cristalizarea fracționată, astfel încât să poată cristaliza încet și într-un mod controlat..
De exemplu, această tehnică este utilizată pentru a separa un amestec de carbonați și alum de aceste metale. Procesele de recristalizare trebuie repetate de mai multe ori pentru a garanta cristale de puritate mai mare și fără ioni co-precipitați; o sare de rubidiu care cristalizează cu ioni K+ sau Cs+ pe suprafața sau în interior.
Tehnici mai moderne, cum ar fi utilizarea unei rășini schimbătoare de ioni sau eteri de coroană ca agenți de complexare, permit, de asemenea, izolarea ionilor Rb.+.
Electroliză sau reducere
Odată ce sarea de rubidiu a fost separată și purificată, următorul și ultimul pas este reducerea cationilor Rb+ la metal solid. Pentru a face acest lucru, sarea este topită și supusă electrolizei astfel încât rubidiul să precipite pe catod; sau se folosește un agent de reducere puternic, cum ar fi calciu și sodiu, capabil să piardă rapid electroni și să reducă astfel rubidiul.
Izotopi
Rubidiul se găsește pe Pământ ca doi izotopi naturali: 85Rb și 87Rb. Primul are o abundență de 72,17%, în timp ce al doilea de 27,83%.
87Rb este responsabil ca acest metal să fie radioactiv; cu toate acestea, radiațiile sale sunt inofensive și chiar benefice pentru analiza întâlnirilor. Timpul său de înjumătățire (t1/2) este 4.91010 ani, al căror interval de timp depășește vârsta Universului. Când se descompune, devine izotopul stabil 87Domnul.
Datorită acestui fapt, acest izotop a fost folosit pentru a dat vârsta mineralelor terestre și a rocilor prezente de la începutul Pământului..
Pe lângă izotopi 85Rb și 87Rb, există alte sintetice și radioactive cu durate de viață variabile și mult mai scurte; De exemplu, el 82Rb (t1/2= 76 secunde), 83Rb (t1/2= 86,2 zile), 84Rb (t1/2= 32,9 zile) și 86Rb (t1/2= 18,7 zile). Dintre toate, 82Rb este cel mai utilizat în studiile medicale.
Riscuri
Metal
Rubidiul este un metal atât de reactiv încât trebuie depozitat în fiole de sticlă sub o atmosferă inertă, astfel încât să nu reacționeze cu oxigenul din aer. Dacă blisterul se sparge, metalul poate fi plasat în kerosen sau ulei mineral pentru a-l proteja; cu toate acestea, va ajunge să fie oxidat de oxigenul dizolvat în ele, dând naștere la peroxizi de rubidiu.
Dacă, dimpotrivă, se decide așezarea pe lemn, de exemplu, va ajunge să ardă cu o flacără violetă. Dacă există multă umiditate, va arde doar prin expunerea la aer. Când o bucată mare de rubidiu este aruncată într-un volum de apă, aceasta explodează energic, chiar aprinzând hidrogenul gazos produs.
Prin urmare, rubidiul este un metal pe care nu toată lumea ar trebui să-l manipuleze, deoarece practic toate reacțiile sale sunt explozive..
Ion
Spre deosebire de rubidiu metalic, ionii săi Rb+ nu reprezintă niciun risc aparent pentru ființele vii. Acestea dizolvate în apă interacționează cu celulele în același mod ca și ionii K.+.
Prin urmare, rubidiul și potasiul au comportamente biochimice similare; cu toate acestea, rubidiul nu este un element esențial, în timp ce potasiul este. În acest fel, sume apreciabile de Rb+ se poate acumula în interiorul celulelor, celulelor roșii din sânge și viscerelor fără a afecta negativ corpul vreunui animal.
De fapt, s-a estimat că un bărbat adult cu o masă de 80 kg conține aproximativ 37 mg de rubidiu; și că, în plus, o creștere a acestei concentrații în ordinea de 50 până la 100 de ori nu duce la simptome nedorite.
Cu toate acestea, un exces de ioni Rb+ poate ajunge să deplaseze ionii K+; și, în consecință, individul va suferi spasme musculare foarte puternice până la moarte.
Evident, sărurile sau compușii solubili de rubidiu pot declanșa acest lucru imediat, deci niciunul dintre aceștia nu trebuie ingerat. În plus, poate provoca arsuri prin simplul contact, iar printre cele mai toxice putem menționa fluorura (RbF), hidroxidul (RbOH) și cianura (RbCN) ale rubidiului.
Aplicații
Colector de gaz
Rubidiul a fost folosit pentru captarea sau îndepărtarea urmelor de gaze care pot fi în tuburi sigilate sub vid. Tocmai datorită tendinței lor ridicate de a capta oxigen și umiditate în ele, le elimină pe suprafața lor ca peroxizi.
Pirotehnie
Când sărurile de rubidiu ard, ele degajă o flacără caracteristică roșiatică-violetă. Unele artificii au aceste săruri în compoziția lor, astfel încât să explodeze cu aceste culori.
Supliment
Clorura de rubidiu a fost prescrisă pentru combaterea depresiei, deoarece studiile au determinat o deficiență a acestui element la persoanele care suferă de această afecțiune. De asemenea, a fost utilizat ca sedativ și pentru tratarea epilepsiei.
Condensat Bose-Einstein
Atomi izotopici 87Rb au fost folosite pentru a crea primul condensat Bose-Einstein. Această stare a materiei constă în aceea că atomii la o temperatură destul de apropiată de zero absolut (0 K), sunt grupați sau „condensați”, comportându-se ca și cum ar fi unul..
Astfel, rubidiul a fost protagonistul acestui triumf în domeniul fizicii și Eric Cornell, Carl Wieman și Wolfgang Ketterle au primit premiul Nobel în 2001 datorită acestei lucrări..
Diagnosticul tumorii
Radioizotopul sintetic 82Rb se descompune prin emiterea de pozitroni, care se folosește pentru a se acumula în țesuturile bogate în potasiu; precum cele localizate în creier sau inimă. Se utilizează astfel pentru a analiza funcționalitatea inimii și prezența posibilelor tumori în creier prin intermediul unei tomografii cu emisie de pozitroni..
Componenta
Ionii de rubidiu și-au găsit un loc în diferite tipuri de materiale sau amestecuri. De exemplu, aliajele sale au fost realizate cu aur, cesiu, mercur, sodiu și potasiu. A fost adăugat la pahare și ceramică, probabil pentru a le mări punctul de topire.
În celulele solare, perovskitele au fost adăugate ca o componentă importantă. De asemenea, a fost studiată și utilizarea sa posibilă ca generator termoelectric, material de transfer de căldură în spațiu, combustibil în motoarele de propulsie cu ioni, mediu electrolitic pentru baterii alcaline și în magnetometre atomice..
Ceasuri atomice
Cu rubidiu și cesiu, au fost fabricate faimoasele ceasuri atomice extrem de precise, utilizate de exemplu în sateliții GPS cu care proprietarii de smartphone-uri își pot afla locația în timp ce se deplasează pe un drum.
Referințe
- Bond Tom. (29 octombrie 2008). Rubidiu. Recuperat de pe: chemistryworld.com
- Shiver & Atkins. (2008). Chimie anorganică. (A patra editie). Mc Graw Hill.
- Wikipedia. (2019). Rubidiu. Recuperat de pe: en.wikipedia.org
- Centrul Național pentru Informații despre Biotehnologie. (2019). Rubidiu. Baza de date PubChem. CID = 5357696. Recuperat de la: pubchem.ncbi.nlm.nih.gov
- Chellan, P. și Sadler, P. J. (2015). Elementele vieții și medicamentele. Tranzacții filosofice. Seria A, Științe matematice, fizice și inginerești, 373 (2037), 20140182. doi: 10.1098 / rsta.2014.0182
- Fundația Mayo pentru educație și cercetare medicală. (2019). Rubidium Rb 82 (Calea intravenoasă). Recuperat de pe: mayoclinic.org
- Marques Miguel. (s.f.). Rubidiu. Recuperat de la: nautilus.fis.uc.pt
- James L. Dye. (12 aprilie 2019). Rubidiu. Encyclopædia Britannica. Recuperat de pe: britannica.com
- Dr. Doug Stewart. (2019). Fapte despre elementul rubidiu. Chemicool. Recuperat de pe: chemicool.com
- Michael Pilgaard. (10 mai 2017). Reacțiile chimice ale rubidiului. Recuperat de pe: pilgaardelements.com



Nimeni nu a comentat acest articol încă.