
Structura, utilizările, obținerea, riscurile, proprietățile dioxidului de clor (ClO2)

dioxid de clor Este un compus anorganic format din elementul clor (Cl) și oxigen (O). Formula sa chimică este ClODouă. Este un gaz galben-verzui până la roșiatic. Nu se găsește în mod natural în mediu.
Este extrem de reactiv, deci este obișnuit ca acesta să fie pregătit acolo unde urmează să fie utilizat. Una dintre cele mai importante utilizări ale sale este ca microbicid, antiseptic și deodorizant, deoarece elimină bacteriile, virușii și ciupercile foarte ușor și în concentrații foarte scăzute..

Vă permite să dezinfectați alimente precum legume, fructe, carne, carne de pasăre și fructe de mare. Se utilizează pentru igienizarea suprafețelor, podelelor, băilor, sistemelor de ventilație, piscinelor, echipamentelor de laborator, echipamentelor dentare etc..
Din acest motiv, este utilizat în procesarea alimentelor, în spitale și clinici, în industrii și magazine. Este folosit pentru purificarea apei potabile și a apelor uzate municipale.
Este foarte eficient ca agent oxidant, motiv pentru care este folosit la înălbirea pastei de hârtie, uleiuri, făină, piele, fibre textile, printre altele..
Când este sub formă de gaz, este foarte periculos, deoarece este extrem de exploziv și este utilizat în principal în soluții apoase. Este toxic dacă este inhalat.
Indice articol
- 1 Structură
- 2 Nomenclatură
- 3 Proprietăți
- 3.1 Starea fizică
- 3.2 Greutate moleculară
- 3.3 Punctul de topire
- 3.4 Punctul de fierbere
- 3.5 Densitate
- 3.6 Solubilitate
- 3.7 Proprietăți chimice
- 3.8 Proprietățile soluțiilor sale apoase
- 3.9 Alte proprietăți
- 4 Obținerea
- 5 Se utilizează ca dezinfectant
- 5.1 În alimente
- 5.2 Pe hârtie și carton care vor intra în contact cu produsele alimentare
- 5.3 În apă potabilă
- 5.4 În stomatologie
- 5.5 În aplicații medicale
- 6 Alte utilizări
- 7 Riscuri
- 8 Referințe
Structura
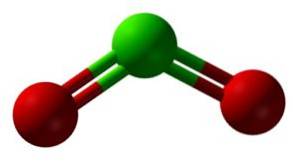
Dioxidul de clor se formează prin uniunea unui atom de clor (Cl) cu doi atomi de oxigen (O). Legăturile de clor cu fiecare oxigen sunt covalente și duble. Clorul din acest compus are o valență de +4.
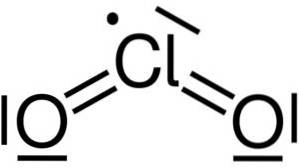
Are o structură simetrică și unghiulară, deoarece are electroni liberi. Adică nu formează o legătură cu niciun alt atom.
Nomenclatură
- Dioxid de clor
- Oxid de clor (iv)
Proprietăți
Starea fizică
Gaz galben-verzui până la galben-roșcat.
Greutate moleculară
67,45 g / mol.
Punct de topire
-59 ° C.
Punct de fierbere
11 ° C.
Densitate
Lichid la 0 ° C = 1.642 g / cm3
Gaz = 2,33 (densitate relativă la aer, aer = 1).
Solubilitate
Solubil în apă: 2000 cm3 al ClODouă gaz în 100 cm3 de apă rece sau 0,8 g / 100 ml de apă la 20 ° C. Solubil în soluție alcalină și în soluție de acid sulfuric HDouăSW4.
Proprietăți chimice
ClODouă este extrem de reactiv și poate exploda violent. Este un agent oxidant foarte eficient.
ClODouă se descompune violent dacă intră în contact cu materiale organice. Dacă se află în aer la o concentrație mai mare de 10%, poate exploda din cauza efectului luminii solare sau a căldurii.
De asemenea, poate detona în prezența mercurului (Hg) sau a monoxidului de carbon (CO).
Sub acțiunea luminii ultraviolete (UV) sau a ozonului, ClODouă devine hexoxid de clor ClDouăSAU6, compus foarte instabil.
Proprietățile soluțiilor dvs. apoase
Soluțiile sale apoase sunt galbene sau galbene roșiatice. Sunt stabile dacă sunt păstrate la rece, bine sigilate și protejate de lumina soarelui. În prezența luminii, aceste soluții se descompun încet pentru a da acid clorhidric HCl și acid clorhidric HClO.3.

În soluții alcaline, ClODouă se descompune în ioni clorit ClODouă- și clorura ClO3-. HClO acid cloros se formează în soluții acideDouă și apoi aceasta se descompune în acid clorhidric HCl și acid clorhidric HClO3.
Alte proprietăți
Vaporii concentrati de ClODouă sunt potențial explozivi, deci nu a fost posibilă comprimarea singură sau amestecată cu alte gaze. Din acest motiv, este de preferat să-l pregătiți pe site-ul unde urmează să fie utilizat..
Când este la temperaturi foarte scăzute în forma sa hidratată, care este modul în care este uneori transferat, este un solid în formă de bloc similar cu culoarea gheață și portocaliu..
Are un miros similar cu clorul. Este toxic prin inhalare.
Obținerea
Poate fi obținut în mai multe moduri. De exemplu, în unele cazuri soluții ClODouă sunt preparate prin trecerea unui amestec de clor gazos (ClDouă) și aer (sau clor gazos și azot NDouă) printr-o coloană conținând granule de clorit de sodiu (NaClODouă).
2 NaClODouă + ClDouă → 2 NaCI + 2 ClODouă
Produsul generat conține aproximativ 90% ClODouă, printre alți compuși ai clorului.
Se obține și din clorat de potasiu (KClO3) și acid sulfuric (HDouăSW4) în prezența acidului oxalic ca agent reducător. În acest caz, dioxidul de carbon (CODouă) folosit pentru a dilua ClODouă.
Poate fi preparat la locul de utilizare pornind de la cloratul de sodiu (NaClO3), acid sulfuric (HDouăSW4) și metanol (CH3OH).
În industrie este obținut prin clorat de sodiu (NaClO3) și dioxid de sulf (SODouă) în prezența acidului sulfuric.
2 NaClO3 + SWDouă + HDouăSW4 → 2 ClODouă + 2 NaHSO4
Se utilizează ca dezinfectant
Poate fi folosit ca un agent antimicrobian puternic. S-a constatat că este extrem de eficient împotriva diferitelor microorganisme, cum ar fi Escherichia coli si Staphylococcus aureus.
Cu acesta din urmă, este suficientă o concentrație de doar 5 ppm de ClODouă pentru a elimina 100% din ele. Este bactericid, antiseptic și dezodorizant. Este eficient pe o gamă largă de pH.
În mâncare
Este utilizat ca agent antimicrobian în apă pentru fumigarea fructelor și legumelor, la prelucrarea păsărilor, a cărnii roșii, atât a bucăților de carne, cât și a organelor, precum și a produselor marine, cum ar fi crustaceele..

Soluțiile de dioxid de clor trebuie utilizate la o concentrație care nu depășește 3 ppm (părți pe milion) de ClODouă rezidual, astfel încât să nu aibă efect asupra alimentelor.
După tratamentul cu ClODouă toate alimentele trebuie clătite bine cu apă potabilă sau destinate albirii, gătirii sau conservării.
În cazul produselor marine, soluția ClODouă Ar trebui să fie utilizat în apă și gheață folosite la clătire, spălare, decongelare, transport sau depozitare. Crustaceele crude trebuie apoi spălate bine cu apă potabilă înainte de consum..

Pe hârtie și carton care vor intra în contact cu mâncarea
Soluții ClODouă sunt utilizate pentru a elimina microorganismele cauzatoare de nămol (cum ar fi algele, bacteriile și ciupercile) din apa de proces utilizată la fabricarea hârtiei și a cartonului care vor intra în contact cu alimentele.
În apă potabilă
Se folosește pentru a purifica apa și a o face potabilă (sigură pentru băut). Se utilizează în pretratarea apei care va fi ulterior îmbuteliată pentru băut sau a apei care va fi folosită ca ingredient în fabricarea băuturilor sau băuturilor răcoritoare..

În stomatologie
Se folosește în instrumentele folosite de dentist sau dentist pentru a le dezinfecta și a distruge organismele patogene din ele.
În aplicații medicale
Soluții apoase de ClODouă au fost utilizate pentru tratarea infecțiilor cu drojdie orală (infecție la nivelul gurii). Candidoza este o infecție cauzată de ciupercă Candida albicans.
Dioxidul de clor ucide ciuperca gurii și îmbunătățește semnificativ aspectul țesuturilor orale fără efecte secundare.
Unii cercetători medicali indică faptul că soluțiile ClODouă aplicat pe răni în urma operațiilor chirurgicale poate reduce sau suprima formarea aderenței fără a afecta vindecarea acesteia, cu avantajul suplimentar al proprietăților sale antiseptice.
Alte utilizări
Datorită proprietăților sale oxidante și microbicide, ClODouă este folosit pentru:
- Albirea pastei din lemn în fabricarea celulozei și hârtiei, oferind o strălucire stabilă.
- Albirea grăsimilor și uleiurilor, pielii, albirea făinii și a textilelor.
- Aplicații agricole, cum ar fi dezinfectarea suprafețelor dure, echipamente, sisteme de apă și sere de ciuperci.
- Aplicații în industrii, magazine și spitale, cum ar fi dezinfectarea suprafețelor dure (pereți, podele, băi), sisteme de ventilație, echipamente de laborator.
- Dezinfectați podelele și băile caselor, sistemele de aer condiționat, sistemele de circulație a apei din piscină.
- Tratarea apelor uzate municipale și industriale.
- Curățarea poluării câmpului petrolier.
- Fabricarea sărurilor de clorură (Cl-).
Riscuri
- Vaporii concentrati de ClODouă sunt potențial explozivi.
- Este toxic prin inhalare și ingestie. Este iritant pentru ochi, nas și gât, poate provoca edem pulmonar și bronșită cronică.
- Potrivit surselor consultate, ClODouă nu provoacă mutații ADN sau provoacă cancer la om.
Referințe
- S.U.A. Biblioteca Națională de Medicină. (2019). Dioxid de clor. Recuperat de la pubchem.ncbi.nlm.nih.gov.
- Decan, J.A. (editor). (1973). Manualul de chimie al lui Lange (ediția a unsprezecea). Compania de carte McGraw-Hill.
- Enciclopedia lui Ullmann de chimie industrială. (1990). Ediția a cincea. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert și Wilkinson, Geoffrey. (1980). Chimie anorganică avansată. A patra editie. John Wiley & Sons.
- Bajpai, P. (2012). Albire cu dioxid de clor. Efectul albirii cu dioxid de clor asupra calității pastei. În abordări ecologice benigne pentru albirea pulpei (ediția a doua). Recuperat de la sciencedirect.com.
- Moran, S. (2018). Chimia apei. Dioxid de clor. Într-un ghid aplicat pentru proiectarea instalației de tratare a apei și efluenților Recuperat de la sciencedirect.com.
- McKeen, L. (2012). Introducere în iradierea alimentelor și sterilizarea medicală. Dioxid de clor gazos. În Efectul sterilizării asupra materialelor plastice și elastomeri (ediția a treia). Recuperat de la sciencedirect.com.



Nimeni nu a comentat acest articol încă.