
Proprietăți, utilizări și exemple de săruri organice

săruri organice sunt un număr dens de compuși ionici cu nenumărate caracteristici. Acestea sunt derivate anterior dintr-un compus organic, care a suferit o transformare care îi permite să poarte o sarcină și, de asemenea, identitatea sa chimică depinde de ionul asociat.
Două formule chimice foarte generale pentru sărurile organice sunt prezentate în imaginea de mai jos. Primul, R-AX, este interpretat ca un compus în a cărui structură de carbon un atom sau grupa A poartă o sarcină pozitivă + sau negativă (-).
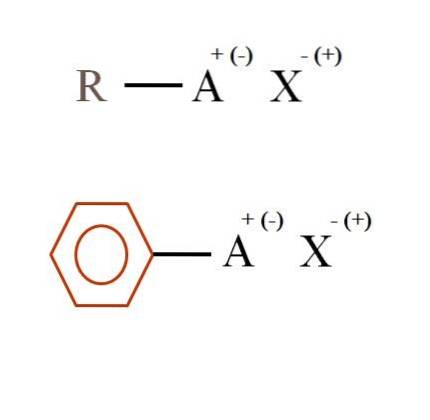
După cum se poate vedea, există o legătură covalentă între R și A, RA, dar la rândul său, A are o sarcină formală care atrage (sau respinge) ionul X. Semnul sarcinii va depinde de natura lui A și de mediu chimic.
Dacă A ar fi pozitiv, cu câte X ar putea interacționa? Cu unul singur, dat fiind principiul electroneutralității (+ 1-1 = 0). Totuși, care este identitatea lui X? Anionul X ar putea fi CO3Două-, necesitând doi cationi RA+; o halogenură: F-, Cl-, Fr-, etc .; sau chiar un alt compus RA-. Opțiunile sunt incalculabile.
De asemenea, o sare organică poate avea un caracter aromatic, ilustrat de inelul de benzen brun. Sarea benzoat de cupru (II), (C6H5GÂNGURI)DouăCu, de exemplu, constă din două inele aromatice cu grupări carboxil încărcate negativ, care interacționează cu cationul Cu.Două+.
Indice articol
- 1 Proprietăți fizice și chimice
- 1.1 Masele moleculare ridicate
- 1.2 Amfifile și surfactanți
- 1.3 Puncte de fierbere sau de topire ridicate
- 1.4 Aciditate și basicitate
- 2 utilizări
- 3 Exemple de săruri organice
- 3.1 Carboxilați
- 3.2 Diakilcuprati de litiu
- 3.3 Săruri de sulfoniu
- 3.4 Săruri de oxoniu
- 3.5 Săruri de amină
- 3.6 Săruri de diazoniu
- 4 Referințe
Proprietati fizice si chimice
Din imagine se poate spune că sărurile organice constau din trei componente: organicul, R sau Ar (inelul aromatic), un atom sau grup care poartă sarcina ionică A și un contraion X.
La fel cum identitatea și structura chimică sunt definite de astfel de componente, în același mod în care proprietățile lor depind de ele..
Din acest fapt, se pot rezuma anumite proprietăți generale pe care marea majoritate a acestor săruri le îndeplinesc..
Masele moleculare ridicate
Presupunând anioni X anorganici mono sau polivalenți, sărurile organice tind să aibă mase moleculare mult mai mari decât sărurile anorganice. Acest lucru se datorează în principal scheletului de carbon, ale cărui legături C-C unice și atomii lor de hidrogen, contribuie cu o mulțime de masă la compus..
Prin urmare, R sau Ar sunt responsabili pentru masele lor moleculare ridicate..
Amfifile și surfactanți
Sărurile organice sunt compuși amfifili, adică structurile lor au atât capete hidrofile, cât și hidrofobe..
Care sunt astfel de extreme? R sau Ar reprezintă hidrofobul extrem, deoarece atomii lor de C și H nu au o afinitate mare pentru moleculele de apă.
LA+(-), atomul sau grupul purtător de sarcină este capătul hidrofil, deoarece contribuie la momentul dipol și interacționează cu apa, formând dipoli (RA+ OhDouă).
Când regiunile hidrofile și hidrofobe sunt polarizate, sarea amfifilică devine un agent tensioactiv, o substanță utilizată pe scară largă pentru fabricarea detergenților și demulsificatori.
Puncte ridicate de fierbere sau topire
La fel ca sărurile anorganice, sărurile organice au și puncte de topire și fierbere ridicate, datorită forțelor electrostatice care guvernează faza lichidă sau solidă..
Cu toate acestea, deoarece există o componentă organică R sau Ar, participă și alte tipuri de forțe Van der Waals (forțe londoneze, dipol-dipol, legături de hidrogen) care concurează într-un anumit mod cu electrostatica..
Din acest motiv, structurile solide sau lichide ale sărurilor organice sunt, în primă instanță, mai complexe și mai variate. Unii dintre ei se pot comporta chiar și așa cristale lichide.
Aciditate și basicitate
Sărurile organice sunt în general acizi sau baze mai puternice decât sărurile anorganice. Acest lucru se datorează faptului că A, de exemplu în sărurile de amină, are o sarcină pozitivă datorită legăturii sale cu un hidrogen suplimentar: A+-H. Apoi, în contact cu o bază, donați protonul pentru a deveni din nou un compus neutru:
RA+H + B => RA + HB
H aparține lui A, dar este scris deoarece participă la reacția de neutralizare.
Pe de altă parte, RA+ Poate fi o moleculă mare, incapabilă să formeze solide cu o rețea cristalină suficient de stabilă cu anionul hidroxil sau hidroxil OH-.
Când este așa, sarea RA+Oh- se comportă ca o bază puternică; chiar la fel de simplu ca NaOH sau KOH:
RA+Oh- + HCI => RACl + HDouăSAU
Rețineți în ecuația chimică că anionul Cl- înlocuiește OH-, formând sarea RA+Cl-.
Aplicații
Utilizarea sărurilor organice va varia în funcție de identitatea R, Ar, A și X. În plus, aplicarea lor depinde și de tipul de solid sau lichid pe care îl formează. Unele generalități în acest sens sunt:
-Aceștia servesc drept reactivi pentru sinteza altor compuși organici. RAX poate acționa ca un „donator” pentru lanțul R pentru a se adăuga la un alt compus înlocuind un grup bun de părăsire.
-Sunt agenți tensioactivi, deci pot fi folosiți și ca lubrifianți. Sărurile metalice ale carboxilaților sunt utilizate în acest scop.
-Acestea permit sintetizarea unei game largi de coloranți.
Exemple de săruri organice
Carboxilați
Acizii carboxilici reacționează cu un hidroxid într-o reacție de neutralizare, dând naștere sărurilor carboxilate: RCOO- M+; unde M+ poate fi orice cation metalic (Na+, PbDouă+, K+, etc.) sau cationul de amoniu NH4+.
Acizii grași sunt acizi carboxilici cu lanț alifatic lung, pot fi saturați și nesaturați. Printre cei saturați se numără acidul palmitic (CH3(CHDouă)14COOH). Aceasta provine din sarea de palmitat, în timp ce acidul stearic (CH3(CHDouă)16COOH formează sarea stearat. Săpunurile sunt formate din aceste săruri.
Pentru cazul acidului benzoic, C6H5COOH (unde C6H5- este un inel benzenic), când reacționează cu o bază, formează săruri de benzoat. În toți carboxilații grupul -COO- reprezintă A (RAX).
Diakylcuprates de litiu
Diakilcupratul de litiu este util în sinteza organică. Formula sa este [R-Cu-R]-Li+, în care atomul de cupru poartă o sarcină negativă. Aici, cuprul reprezintă atomul A din imagine.
Săruri de sulfoniu
Acestea sunt formate din reacția unei sulfuri organice cu o halogenură de alchil:
RDouăS + R'X => RDouăR'S+X
Pentru aceste săruri, atomul de sulf are o sarcină formală pozitivă (S+) având trei legături covalente.
Săruri de oxoniu
La fel, eterii (analogii oxigenați ai sulfurilor) reacționează cu hidrații pentru a forma săruri de oxoniu:
ROR '+ HBr <=> RO+HR '+ fr-
Protonul acid al HBr este legat covalent de atomul de oxigen al eterului (RDouăSAU+-H), încărcându-l pozitiv.
Săruri de amină
Aminele pot fi primare, secundare, terțiare sau cuaternare, ca sărurile lor. Toate acestea se caracterizează prin faptul că au un atom de H legat de atomul de azot.
Astfel, RNH3+X- este o sare aminică primară; RDouăNHDouă+X-, amină secundară; R3NH+X-, amină terțiară; și R4N+X-, amină cuaternară (sare de amoniu cuaternară).
Săruri de diazoniu
În cele din urmă, sărurile de diazoniu (RNDouă+X-) sau arildiazoniu (ArNDouă+X-), reprezintă punctul de plecare al multor compuși organici, în special coloranții azoici.
Referințe
- Francis A. Carey. Chimie organica. (Ediția a șasea, paginile 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Wikipedia. (2018). Sare (chimie). Luat de pe: en.wikipedia.org
- Steven A. Hardinger. (2017). Glosar ilustrat de chimie organică: săruri. Recuperat de la: chem.ucla.edu
- Chevron Oronite. (2011). Carboxilați. [PDF]. Recuperat de pe: oronite.com


Nimeni nu a comentat acest articol încă.