
Caracteristici și exemple de soluție concentrată

A soluție concentrată Este unul care conține o cantitate mare de solut în raport cu cantitatea pe care ar putea să o dizolve; în timp ce o soluție diluată are o concentrație scăzută de solut. O soluție diluată poate fi preparată dintr-o soluție concentrată prin adăugarea de solvent la aceasta sau, dacă este posibil, extragerea soluției din ea..
Conceptul poate fi relativ, deoarece ceea ce definește o soluție concentrată sunt valori ridicate în unele dintre proprietățile sale; de exemplu, o bezea de înghețată are o concentrație ridicată de zahăr, lucru dovedit de gustul său dulce.
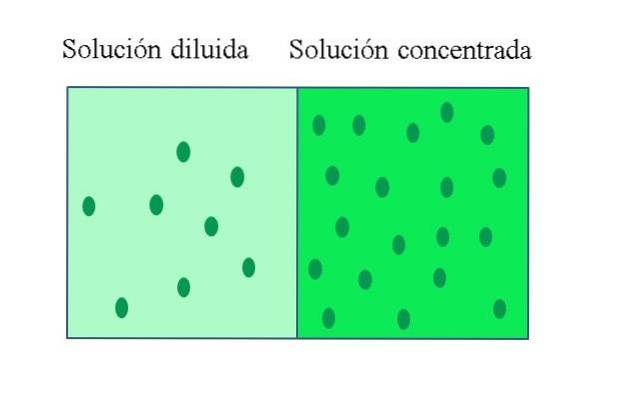
Concentrația soluției unei soluții concentrate este apropiată sau egală cu cea a unei soluții saturate. Principala caracteristică a unei soluții saturate este că nu poate solubiliza o cantitate suplimentară de substanță dizolvată la o anumită temperatură. Prin urmare, concentrația solutului în soluțiile sale saturate rămâne constantă..
Solubilitatea majorității substanțelor dizolvate crește odată cu creșterea temperaturii. În acest fel, o cantitate suplimentară de substanță dizolvată poate fi solubilizată într-o soluție saturată..
Apoi, pe măsură ce temperatura scade, concentrația solutului din soluția saturată crește. Vorbind în acest caz de o soluție suprasaturată.
Indice articol
- 1 Caracteristica unei soluții concentrate
- 2 Proprietăți colective ale soluțiilor
- 2.1 Osmolaritatea și osmolalitatea
- 2.2 Reducerea presiunii de vapori
- 2.3 Coborârea punctului crioscopic
- 2.4 Cota punctului de fierbere
- 2.5 Presiunea osmotică
- 3 Diferențe cu soluția diluată
- 4 Exemple de soluții
- 4.1 Concentrat
- 4.2 Diluat
- 5 Referințe
Caracteristică unei soluții concentrate
Concentrația unei soluții, adică relația dintre cantitatea de dizolvat și cantitatea de soluție sau solvent, poate fi exprimată ca procent de soluție în soluție (P / V sau P / P).
Poate fi, de asemenea, exprimat în moli de dizolvat pe litru de soluție (molaritate) și echivalenți de dizolvat pe litru de soluție (normalitate).
De asemenea, este obișnuit să se exprime concentrația unei soluții în moli de dizolvat pe kilogram de solvent (molalitate) sau să o exprime în moli de dizolvat în raport cu moli total ai soluției (fracție molară). În soluțiile diluate este obișnuit să se găsească concentrația unei soluții în p.p.m. (părți per milion).
Oricare ar fi forma de exprimare a concentrației unei soluții, o soluție concentrată are o proporție mare de substanță dizolvată, în acest caz exprimată ca masă, în raport cu masa sau volumul soluției sau solventului. Această concentrație fiind egală cu solubilitatea solutului în solvent sau foarte aproape de valoarea acestuia..
Proprietăți colective ale soluțiilor
Acestea sunt un set de proprietăți ale soluțiilor care depinde de numărul de particule din soluție, indiferent de tipul lor.
Proprietățile coligative nu discriminează caracteristicile particulelor, indiferent dacă sunt atomi de sodiu, clor, glucoză etc. Important este numărul tău.
Datorită acestui fapt, a devenit necesar să se creeze un mod diferit de exprimare a concentrației unei soluții care este legată de așa-numitele proprietăți coligative. Ca răspuns la aceasta, au fost create expresiile osmolaritate și osmolalitate.
Osmolaritatea și osmolalitatea
Osmolaritatea este legată de molaritatea soluției și osmolalitatea de molalitatea acesteia..
Unitățile de osmolaritate sunt osm / L de soluție sau mosm / L de soluție. În timp ce unitățile de osmolalitate sunt osm / kg de apă sau mosm / kg de apă.
Osmolaritate = mvg
m = molaritatea soluției.
v = numărul de particule în care un compus se disociază în soluție apoasă. De exemplu: pentru NaCl, v are o valoare de 2; pentru CaClDouă, v are o valoare de 3 iar pentru glucoză, un compus electrolitic care nu se disociază, v are o valoare de 1.
g = coeficient osmotic, factor de corecție pentru interacțiunea particulelor încărcate electric în soluție. Acest factor de corecție are o valoare apropiată de 1 pentru soluțiile diluate și tinde la zero pe măsură ce crește molaritatea compusului electrolitic..
Proprietățile coligative sunt menționate mai jos, care permit determinarea cantității concentrate a unei soluții.
Reducerea presiunii vaporilor
Când apa este încălzită, aceasta se evaporă și aburul format exercită o presiune. Pe măsură ce se adaugă substanță dizolvată, presiunea vaporilor scade.
Prin urmare, soluțiile concentrate au o presiune de vapori scăzută. Explicația este că moleculele dizolvate deplasează moleculele de apă la interfața apă-aer..
Coborârea punctului crioscopic
Pe măsură ce osmolaritatea unei soluții crește, temperatura la care soluția apoasă îngheață scade. Dacă temperatura de îngheț a apei pure este de 0 ° C, temperatura de îngheț a unei soluții apoase concentrate devine mai mică decât această valoare..
Cota punctului de fierbere
Conform legii lui Raoult, creșterea punctului de fierbere al solventului pur este direct proporțională cu molaritatea soluției care provine din adăugarea de solut. Prin urmare, soluțiile concentrate au un punct de fierbere mai mare decât apa..
Presiune osmotica
Există două compartimente cu concentrații diferite, separate de o membrană care permite trecerea apei, dar restricționează trecerea particulelor de solut..
Apa va curge din soluția cu cea mai mică concentrație de substanță dizolvată către soluția cu cea mai mare concentrație de substanță dizolvată.
Acest debit net de apă va dispărea treptat pe măsură ce apa acumulată în compartimentul cu cea mai mare concentrație generează o presiune hidrostatică care se opune fluxului de apă în acest compartiment..
Fluxul de apă prin osmoză are loc în general către soluții concentrate.
Diferențe cu soluția diluată
-Soluțiile concentrate au o proporție mare de solut în raport cu volumul sau masa soluției. Soluțiile diluate au o proporție redusă de substanță dizolvată în raport cu volumul sau masa soluției.
-Au o molaritate, molalitate și normalitate mai mari decât cele ale soluțiilor diluate.
-Punctul de îngheț al soluțiilor concentrate este mai mic decât cel al soluțiilor diluate; adică îngheață la temperaturi mai reci.
-O soluție concentrată are o presiune de vapori mai mică decât o soluție diluată.
-Soluțiile concentrate au un punct de fierbere mai mare decât soluțiile diluate.
-Punută în contact printr-o membrană semipermeabilă, apa va curge de la soluțiile diluate la soluțiile concentrate.
Exemple de soluții
Concentrat
-Mierea este o soluție saturată de zahăr. Este frecvent observată apariția recristalizării zahărului, evidențiată în capacele recipientelor care conțin mierea..
-Apa de mare care are o concentrație mare de săruri variate.
-Urina de la persoanele cu deshidratare severă.
-Apa carbogazoasă este o soluție saturată de dioxid de carbon.
Diluat
-Urina de la o persoană cu aport excesiv de apă.
-Sudoarea este de obicei de osmolaritate scăzută.
-Multe medicamente administrate sub formă de soluție au o concentrație scăzută.
Referințe
- Wikipedia. (2018). Concentraţie. Recuperat de pe: es.wikipedia.org
- Falst L. (2018). Concentrarea soluțiilor: definiție și niveluri. Studiu. Recuperat de la: study.com
- Companionul de chimie pentru profesorii de gimnaziu - eșantion. (s.f.). Soluții și concentrare. [PDF]. Recuperat de pe: ice.chem.wisc.edu
- Soluții apoase - Molaritate. Recuperat de la: chem.ucla.edu
- Whitten, Davis, Peck și Stanley. (2008). Chimie. (Ed. A VIII-a). CENGAGE Învățare.


Nimeni nu a comentat acest articol încă.