
Proprietăți, structură, utilizări, exemple de esteri
esteri Sunt compuși organici care au o componentă a acidului carboxilic și o componentă alcoolică. Formula sa chimică generală este RCODouăR' sau RCOOR'. Partea dreaptă, RCOO, corespunde grupului carboxil, în timp ce partea dreaptă, SAU' este alcool. Cei doi împărtășesc un atom de oxigen și au o asemănare cu eterii (ROR ').
Din acest motiv acetat de etil, CH3VĂRĂTORDouăCH3, cel mai simplu dintre esteri, a fost considerat ca fiind acid acetic sau eter de oțet, și de aici și originea etimologică a numelui „ester”. Deci, un ester constă în substituirea hidrogenului acid al grupării COOH, cu o grupare alchil dintr-un alcool.

Unde se găsesc esterii? De la soluri la chimia organică, sursele sale naturale sunt multe. Mirosul plăcut al fructelor, cum ar fi bananele, pere și mere, este produsul interacțiunii esterilor cu multe alte componente. Se găsesc și sub formă de trigliceride din uleiuri sau grăsimi.
Organismul nostru produce trigliceride din acizi grași, care au lanțuri lungi de carbon și alcool glicerol. Ceea ce diferențiază unii esteri de alții rezidă atât în R, în lanțul componentului acid, cât și în R ', cel al componentei alcoolice..
Un ester cu greutate moleculară mică trebuie să aibă puțini atomi de carbon în R și R ', în timp ce alții, cum ar fi cerurile, au mulți atomi de carbon în special în R', componenta alcoolică și, prin urmare, greutăți moleculare ridicate..
Cu toate acestea, nu toți esterii sunt strict organici. Dacă atomul de carbon al grupării carbonil este înlocuit cu unul de fosfor, atunci vom avea RPOOR '. Acest lucru este cunoscut sub numele de ester de fosfat și are o importanță crucială în structura ADN..
Astfel, atâta timp cât un atom se poate lega în mod eficient de carbon sau oxigen, cum ar fi sulful (RSOOR '), poate forma în consecință un ester anorganic.
Indice articol
- 1 Proprietăți
- 1.1 Solubilitatea în apă
- 1.2 Reacția de hidroliză
- 1.3 Reacția de reducere
- 1.4 Reacția de transesterificare
- 2 Structura
- 2.1 Acceptorul legăturii de hidrogen
- 3 Nomenclatură
- 4 Cum sunt formate?
- 4.1 Esterificare
- 4.2 Esteri din cloruri de acil
- 5 utilizări
- 6 Exemple
- 7 Referințe
Proprietăți
Esterii nu sunt nici acizi, nici alcooli, deci nu se comportă ca atare. Punctele lor de topire și fierbere, de exemplu, sunt mai mici decât cele cu greutăți moleculare similare, dar mai apropiate ca valori de cele ale aldehidelor și cetonelor..
Acid butanoic, CH3CHDouăCHDouăCOOH, are un punct de fierbere de 164ºC, în timp ce acetat de etil, CH3VĂRĂTORDouăCH3, de 77,1ºC.
În afară de exemplul recent, punctele de fierbere ale 2-metilbutanului, CH3CH (CH3) CHDouăCH3, de acetat de metil, CH3VĂRĂTOR3, și 2-butanol, CH3,CH (OH) CHDouăCH3, sunt după cum urmează: 28, 57 și 99 ° C. Toți cei trei compuși au greutăți moleculare 72 și 74 g / mol..
Esterii cu greutate moleculară mică tind să fie volatili și să aibă mirosuri plăcute, motiv pentru care conținutul lor din fructe le conferă parfumurile lor familiare. Pe de altă parte, atunci când greutățile lor moleculare sunt mari, acestea sunt solide cristaline incolore și inodore sau, în funcție de structura lor, prezintă caracteristici grase..
Solubilitatea apei
Acizii carboxilici și alcoolii sunt de obicei solubili în apă, cu excepția cazului în care au un caracter hidrofob ridicat în structurile lor moleculare. Același lucru este valabil și pentru esteri. Când R sau R 'sunt lanțuri scurte, esterul poate interacționa cu moleculele de apă prin forțe dipol-dipol și forțe londoneze..
Acest lucru se datorează faptului că esterii sunt acceptori ai legăturilor de hidrogen. Cum? Prin cei doi atomi de oxigen RCOOR '. Moleculele de apă formează legături de hidrogen cu oricare dintre acești oxigeni. Dar când lanțurile R sau R 'sunt foarte lungi, ele resping apa din mediul lor, făcând imposibilă dizolvarea..
Un exemplu evident al acestui lucru se întâmplă cu esterii trigliceridelor. Lanțurile sale laterale sunt lungi și fac uleiurile și grăsimile insolubile în apă, cu excepția cazului în care sunt în contact cu un solvent mai puțin polar, mai asemănător cu aceste lanțuri..
Reacție de hidroliză
Esterii pot reacționa, de asemenea, cu moleculele de apă în ceea ce este cunoscut sub numele de reacție de hidroliză. Cu toate acestea, acestea necesită un mediu suficient de acid sau bazic pentru a promova mecanismul reacției menționate:
RCOOR ' + HDouăSAU <=> RCOOh + R'OH
(Mediu acid)
Molecula de apă se adaugă grupării carbonil, C = O. Hidroliza acidă este rezumată prin substituirea fiecărui R 'al componentei alcoolice cu un OH din apă. Rețineți, de asemenea, modul în care esterul „se rupe” în cele două componente ale sale: acidul carboxilic, RCOOH și alcoolul R'OH..
RCOOR ' + Oh- => RCOSAU- + R'OH
(Mediu de bază)
Când hidroliza se efectuează într-un mediu bazic, apare o reacție ireversibilă cunoscută sub numele de saponificare. Acesta este utilizat pe scară largă și este piatra de temelie în producția de săpunuri artizanale sau industriale..
RCOO- este anionul carboxilat stabil, care se asociază electrostatic cu cationul predominant în mediu.
Dacă baza utilizată este NaOH, se formează sarea RCOONa. Când esterul este un triglicerid, care, prin definiție, are trei lanțuri laterale R, se formează trei săruri de acizi grași, RCOONa și alcoolul glicerol.
Reacție de reducere
Esterii sunt compuși puternic oxidați. Ce înseamnă? Înseamnă că are mai multe legături covalente cu oxigenul. Prin eliminarea legăturilor C-O, apare o ruptură care ajunge să separe componentele acide și alcoolice; Mai mult, acidul este redus la o formă mai puțin oxidată, la un alcool:
RCOOR '=> RCHDouăOH + R'OH
Aceasta este reacția de reducere. Este nevoie de un agent de reducere puternic, cum ar fi hidrura de litiu aluminiu, LiAlH4, și dintr-un mediu acid care promovează migrația electronilor. Alcoolii sunt cele mai mici forme, adică cele cu cele mai puține legături covalente cu oxigenul (doar una: C-OH).
Cei doi alcooli, RCHDouăOH + R'OH, provin din cele două lanțuri respective ale esterului original RCOOR '. Aceasta este o metodă de sinteză a alcoolilor cu valoare adăugată din esterii lor. De exemplu, dacă ați dori să faceți un alcool dintr-o sursă exotică de esteri, acesta ar fi un traseu bun în acest scop..
Reacție de transesterificare
Esterii pot fi transformați în alții dacă reacționează în medii acide sau bazice cu alcooli:
RCOOR ' + R "OH <=> RCOSAU " + R'OH
Structura
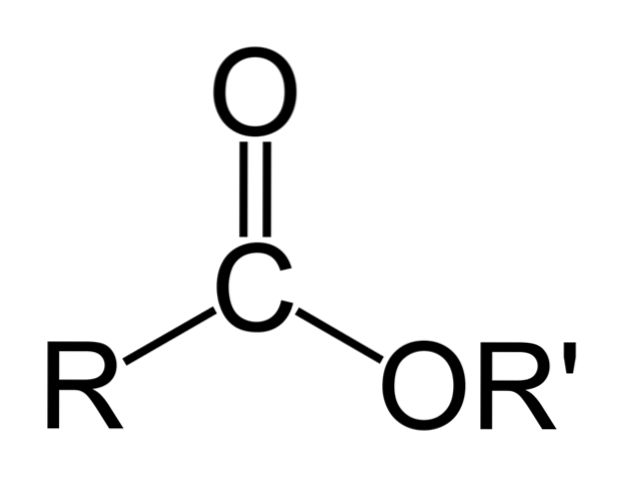
Imaginea de sus reprezintă structura generală a tuturor esterilor organici. Rețineți că R, gruparea carbonil C = O și OR ', formează un triunghi plat, produs al hibridizării spDouă a atomului central de carbon. Cu toate acestea, ceilalți atomi pot adopta alte geometrii, iar structurile lor depind de natura intrinsecă a lui R sau R '.
Dacă R sau R 'sunt lanțuri alchil simple, de exemplu, de tipul (CHDouă)nCH3, acestea vor apărea în zigzag în spațiu. Acesta este cazul butanoatului de pentil, CH3CHDouăCHDouăVĂRĂTORDouăCHDouăCHDouăCHDouăCH3.
Dar în oricare dintre carbonii acestor lanțuri s-ar putea găsi o ramificare sau nesaturare (C = C, C≡C), care ar modifica structura globală a esterului. Și din acest motiv proprietățile sale fizice, cum ar fi solubilitatea și punctele sale de fierbere și topire, variază în funcție de fiecare compus..
De exemplu, grăsimile nesaturate au legături duble în lanțurile lor R, care influențează negativ interacțiunile intermoleculare. Ca urmare, punctele lor de topire scad, până când sunt lichide, sau uleiuri, la temperatura camerei..
Acceptor de legături de hidrogen
Deși triunghiul scheletului ester se remarcă mai mult în imagine, lanțurile R și R 'sunt responsabile de diversitatea structurilor lor..
Cu toate acestea, triunghiul merită o caracteristică structurală a esterilor: sunt acceptori de legături de hidrogen. Cum? Prin oxigenul grupărilor carbonil și alcoxid (-OR ').
Aceștia au perechi de electroni liberi, care pot atrage atomi de hidrogen încărcați parțial pozitivi din moleculele de apă..
Prin urmare, este un tip special de interacțiuni dipol-dipol. Moleculele de apă se apropie de ester (dacă nu sunt împiedicate de lanțurile R sau R ') și se formează punțile C = O-HDouăO sau OHDouă-O-R '.
Nomenclatură
Cum se numesc esterii? Pentru a denumi corect un ester, este necesar să se ia în considerare numărul de atomi de carbon al lanțurilor R și R '. La fel, orice posibilă ramificare, substituent sau nesaturare.
Odată realizat acest lucru, la numele fiecărui R 'al grupei alcoxid -OR' se adaugă sufixul -yl, în timp ce la lanțul R al grupei carboxil -COOR, sufixul -ate. Se menționează mai întâi secțiunea R, urmată de cuvântul „de” și apoi de numele secțiunii R ”.
De exemplu, CH3CHDouăCHDouăVĂRĂTORDouăCHDouăCHDouăCHDouăCH3 Are cinci atomi de carbon pe partea dreaptă, adică corespund cu R '. Și în partea stângă sunt patru atomi de carbon (inclusiv gruparea carbonil C = O). Prin urmare, R 'este o grupare pentil și R un butan (pentru a include carbonilul și a lua în considerare lanțul principal).
Deci, pentru a denumi compusul, trebuie doar să adăugați sufixele corespunzătoare și să le denumiți în ordinea corectă: butanlegat de pentilo.
Cum se numește următorul compus: CH3CHDouăCOOC (CH3)3? Șirul -C (CH3)3 corespunde substituentului terț-butilalchil. Deoarece partea stângă are trei atomi de carbon, este un „propan”. Numele său este atunci: propanlegat de tert-darilo.
Cum sunt formate?
Esterificare
Există multe căi de sintetizare a esterului, dintre care unele pot fi chiar noi. Cu toate acestea, toate converg spre faptul că triunghiul din imaginea structurii trebuie format, adică legătura CO-O. Pentru aceasta, trebuie să începeți de la un compus care anterior are grupa carbonil: cum ar fi un acid carboxilic.
Și la ce ar trebui să se lege acidul carboxilic? Pentru un alcool, altfel nu ar avea componenta alcoolică care caracterizează esterii. Cu toate acestea, acizii carboxilici necesită căldură și aciditate pentru a permite mecanismului de reacție să continue. Următoarea ecuație chimică reprezintă cele menționate mai sus:
RCOOH + R'OH <=> RCOOR '+ HDouăSAU
(Mediu acid)
Acest lucru este cunoscut sub numele de esterificare.
De exemplu, acizii grași pot fi esterificați cu metanol, CH3OH, pentru a înlocui H-ul său acid cu grupări metil, deci această reacție poate fi considerată și ca metilare. Acesta este un pas important atunci când se determină profilul acizilor grași al anumitor uleiuri sau grăsimi..
Esteri din cloruri de acil
O altă modalitate de sintetizare a esterilor este din clorurile de acil, RCOCl. În ele, în loc să se substituie o grupare OH hidroxil, atomul de Cl este substituit:
RCOCl + R'OH => RCOOR '+ HCl
Și spre deosebire de esterificarea unui acid carboxilic, nu se eliberează apă, ci acid clorhidric.
Alte metode sunt disponibile în lumea chimiei organice, cum ar fi oxidarea Baeyer-Villiger, care utilizează peroxiacizi (RCOOOH)..
Aplicații

Printre principalele utilizări ale esterilor se numără:
-La realizarea lumânărilor sau a candelelor, ca cea din imaginea de mai sus. În acest scop se utilizează esteri cu lanț lateral foarte lung..
-Ca conservanți ai medicamentelor sau alimentelor. Acest lucru se datorează acțiunii parabenilor, care nu sunt altceva decât esteri ai acidului para-hidroxibenzoic. Deși păstrează calitatea produsului, există studii care pun sub semnul întrebării efectul său pozitiv asupra organismului.
-Acestea sunt utilizate pentru fabricarea parfumurilor artificiale care imită mirosul și gustul multor fructe sau flori. Astfel, esterii sunt prezenți în dulciuri, înghețate, parfumuri, cosmetice, săpunuri, șampoane, printre alte produse comerciale care merită arome sau arome atractive..
-Esterii pot avea, de asemenea, un efect farmacologic pozitiv. Din acest motiv, industria farmaceutică s-a dedicat sintetizării esterilor derivați din acizi prezenți în organism pentru a evalua orice posibilă îmbunătățire a tratamentului bolilor. Aspirina este unul dintre cele mai simple exemple ale acestor esteri.
-Esterii lichizi, cum ar fi acetat de etil, sunt solvenți adecvați pentru anumite tipuri de polimeri, cum ar fi nitroceluloză și o gamă largă de rășini.
Exemple
Câteva exemple suplimentare de esteri sunt după cum urmează:
-Butanoat de pentil, CH3CHDouăCHDouăVĂRĂTORDouăCHDouăCHDouăCHDouăCH3, care miroase a caise și pere.
-Acetat de vinil, CH3VĂRĂTORDouă= CHDouă, din care se produce polimer acetat de polivinil.
-Pentanoat de izopentil, CH3CHDouăCHDouăCHDouăVĂRĂTORDouăCHDouăCH (CH3)Două, care imită gustul merelor.
-Propanoat de etil, CH3CHDouăVĂRĂTORDouăCH3.
-Metanoat de propil, HCOOCHDouăCHDouăCH3.
Referințe
- T.W. Graham Solomons, Craigh B. Fryhle. Chimie organica. (Ediția a zecea, p 797-802, 820) Wiley Plus.
- Carey, F. A. Chemistry Organic (2006) Ediția a șasea. Editura Mc Graw Hill-
- Chimie LibreTexte. Nomenclatura esterilor. Recuperat de pe: chem.libretexts.org
- Administrator. (2015, 19 septembrie). Esteri: natura, proprietățile și utilizările sale chimice. Luat de la: pure-chemical.com
- Chimia organică în viața noastră de zi cu zi. (9 martie 2014). Care sunt utilizările esterilor? Recuperat de la: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Exemple de esteri. Recuperat de pe: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Principalele aplicații ale esterilor. Luat de pe: uaeh.edu.mx
- Jim Clark. (Ianuarie 2016). Vă prezentăm Esteri. Luat de la: chemguide.co.uk



Nimeni nu a comentat acest articol încă.