
Sulfat de calciu (CaSO4) Structură chimică, proprietăți, utilizări

sulfat de calciu Este o sare ternară de calciu, metal alcalin pământos (domnul Becambara), sulf și oxigen. Formula sa chimică este CaSO4, ceea ce înseamnă că pentru fiecare cation CaDouă+ există un anion SO4Două- interacționând cu acesta. Constituie un compus cu distribuție largă în natură.
Cele mai abundente forme ale sale sunt CaSO42HDouăO (gips) și forma anhidră CaSO4 (anhidritul). Există, de asemenea, o a treia formă: tencuiala din Paris, produsă prin încălzirea tencuielii (hemidratul, CaSO41 / 2HDouăSAU). O porțiune solidă din această sare ternară este prezentată în imaginea inferioară, cu aspectul său albicios..

Indice articol
- 1 Structura chimică
- 2 Proprietăți
- 2.1 Formula moleculară
- 2.2 Greutate moleculară anhidră
- 2.3 Miros
- 2.4 Aspect
- 2.5 Densitate
- 2.6 Punct de topire
- 2.7 Solubilitate
- 2.8 Stabilitate
- 3 utilizări
- 3.1 În construcții și artă
- 3.2 Terapie
- 3.3 În procesarea alimentelor
- 3.4 Ca îngrășământ și balsam pentru solurile cultivate
- 3.5 La producerea altor compuși
- 4 Referințe
Structura chimică
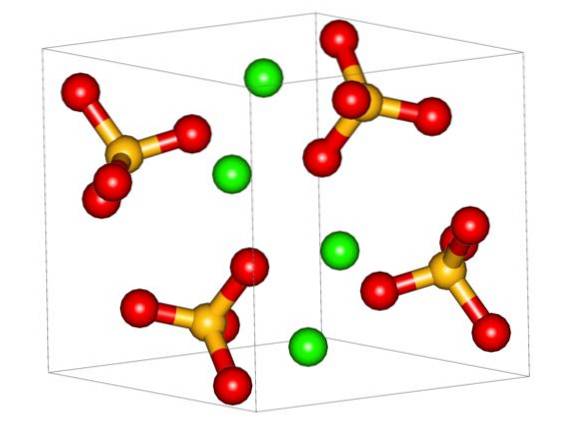
Imaginea superioară prezintă celula unitate ortorombică pentru CaSO4. Aici se presupune că interacțiunile sunt pur electrostatice; adică cationii CaDouă+ atrage anioni tetraedrici SO4Două-.
Cu toate acestea, CaDouă+ este foarte predispus la coordonare, formând structuri poliedrice în jurul său. Pentru ce este asta? La disponibilitatea electronică a calciului pentru a accepta electroni din specii bazice sau negative (cum ar fi atomii de O ai SO4Două-).
Având în vedere punctul anterior, acum ionii Ca.Două+ Aceștia acceptă legături date (furnizate de OS) și celula unității este transformată, așa cum se indică în imaginea de mai jos:
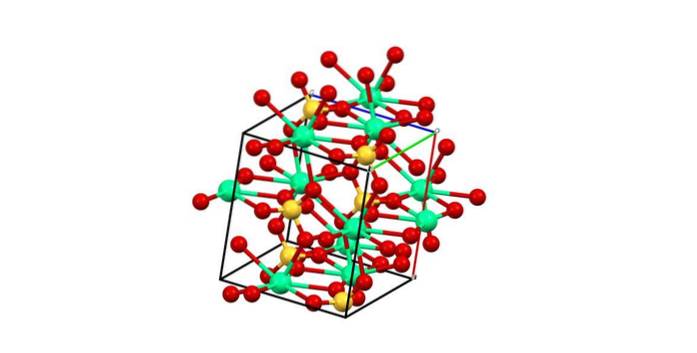
În consecință, se formează poliedrul CaO8 (sfera verde a CaDouă+ înconjurat de opt sfere roșii de O din tetraedrul SO4 din apropiere). Poliedre de calciu și tetraedre de sulfat; aceasta este structura cristalină a CaSO4 anhidru.
În plus, când cristalele se hidratează - formând sarea dihidratată sau hemidratul (CaSO41/2 HDouăO) - structura se extinde pentru a încorpora molecule de apă.
Aceste molecule se pot intercala și coordona cu calciu; adică înlocuiesc una sau două grupări sulfat.
Pe de altă parte, nu toată apa devine parte a poliedrului CaO.8. Unele, pe de altă parte, formează legături de hidrogen cu sulfați. Acestea servesc ca uniune pentru două secțiuni în zigzag, produse ale aranjamentului ionilor în cristal.
Proprietăți
Formulă moleculară
CaSO4 nH2O.
Greutate moleculară anhidră
136,134 g / mol.
Miros
Este inodor.
Aspect
În cazul anhidritei, arată ca o pulbere albă sau cristale solide ortorombice sau monoclinice. Cristalele sunt de culoare variabilă: pot fi albe sau cu o nuanță albăstruie, cenușie sau roșiatică; poate fi și roșu cărămidă.
Densitate
2,96 g / cm3 (formă anhidră). 2,32 gr / cm3 (formă dihidratată).
Punct de topire
1450 ° C (2840 ° F). Caracteristică interacțiunilor electrostatice puternice între ionii divalenți de Ca.Două+ Așadar4Două-.
Solubilitate
0,2-0,3% în apă la 25 ° C. Este slab solubil în apă și insolubil în etanol.
Stabilitate
Stabil la temperatura camerei.
Aplicații

În construcții și în artă
Se folosește la elaborarea stucului pentru a frisa pereții caselor și a altor construcții care contribuie la înfrumusețarea acestuia. În plus, reliefurile sunt realizate prin intermediul matrițelor din tavan și ramele ferestrelor. Tencuiala se află și în tavan.
Sulfatul de calciu este folosit pentru a ajuta la rezolvarea problemei care apare la hidratarea betonului, colaborând astfel la construcția drumurilor, bulevardelor etc..
Cu tencuiala se fac sculpturi, în special figuri religioase, iar în cimitire sunt folosite pe pietre funerare.
Terapeutică
veterinar
Experimental, în medicina veterinară, bucăți sterile de sulfat de calciu au fost folosite pentru a repara defecte osoase sau cavități, cum ar fi cele lăsate de răni sau tumori..
Tencuiala din Paris poate fi utilizată pentru a repara defectele osoase datorită capacității sale unice de a stimula osteogeneza. Studiile cu raze X și tehnonatul (Tc99m) medronat susțin utilizarea tencuielii Parisului ca aloplastic și capacitatea sa osteogenă atunci când sunt implantate în sinusul frontal.
Regenerarea osoasă a fost demonstrată la șase câini într-o perioadă de 4 până la 6 luni. Sulfatul de calciu a început să fie utilizat în acest domeniu în 1957, sub formă de tencuială a tabletelor de la Paris, putând umple defectele oaselor câinilor..
Substituția osoasă a sulfatului de calciu este comparabilă cu cea observată în osul autogen.
Ruhaimi (2001) a aplicat sulfat de calciu pe un os de maxilar de iepure recent distrus, observând o creștere a osteogenezei și a calcificării osoase..
Medicament
Sulfatul de calciu este utilizat în medicină pentru a imobiliza articulațiile dislocate și oasele fracturate, precum și pentru a fi utilizat ca excipient la fabricarea tabletelor..
odontologie
În stomatologie este utilizat ca bază pentru realizarea protezelor dentare, în restaurări și amprente ale dinților..
În procesarea alimentelor
Este folosit ca coagulant în producția de tofu, un aliment fabricat cu soia și consumat pe scară largă în țările din est ca înlocuitor al cărnii. În plus, a fost folosit ca fermitate a alimentelor și în tratarea făinurilor.
Ca îngrășământ și balsam pentru solurile recoltate
Gips (CaSO42HDouăO) a fost folosit ca îngrășământ în Europa încă din secolul al XVIII-lea, având avantajul față de utilizarea varului ca sursă de calciu pentru o mobilitate mai mare.
Calciul trebuie să fie disponibil pentru rădăcinile plantelor pentru aprovizionarea adecvată. Așadar, adăugarea de calciu îmbunătățește culturile horticole și de arahide (arahide)..
Putregaiul rădăcinii de arahide cauzat de agenții patogeni biologici, precum și putregaiul de pepene verde și de floare de roșie, sunt parțial controlate cu aplicații agricole de gips..
Gipsul ajută la reducerea dispersiei argilei, ceea ce determină formarea crustelor pe sol. Prin reducerea crustelor formate pe sol, tencuiala facilitează ieșirea răsadurilor. De asemenea, crește intrarea aerului și a apei în sol.
Gipsul ajută la îmbunătățirea solului prin atenuarea acidității și toxicității aluminiului, adaptând astfel cultura pentru solurile de sodiu.
La producerea altor compuși
Sulfatul de calciu reacționează cu bicarbonatul de amoniu pentru a forma sulfat de amoniu. De asemenea, a fost utilizat în procesul de producere a acidului sulfuric.
Sulfatul de calciu anhidru este amestecat cu șist sau slab și, pe măsură ce amestecul este încălzit, trioxidul de sulf este eliberat sub formă gazoasă. Oxidul de sulf este un precursor al acidului sulfuric.
Referințe
- Smokefoot. (26 decembrie 2015). Structura CaSO4. [Figura]. Adus pe 6 mai 2018, de pe: commons.wikimedia.org
- Takanori Fukami și colab. (2015). Sinteza, structura cristalină și proprietățile termice ale CaSO42HDouăSau cristale unice. Jurnalul Internațional de Chimie; Vol. 7, nr. 2; ISSN 1916-9698 E-ISSN 1916-9701 Publicat de Centrul canadian de știință și educație.
- PubChem. (2018). Sulfat de calciu. Adus la 6 mai 2018, de la: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Sulfat de calciu. Adus pe 06 mai 2018, de pe: en.wikipedia.org
- Elsevier. (2018). sulfat de calciu. Adus pe 6 mai 2018, de pe: sciencedirect.com
- Kimberlitesoftwares. (2018). Sulfat de calciu. Adus pe 6 mai 2018, de pe: worldofchemicals.com
- Intagri. (2017). Manual pentru utilizarea gipsului agricol ca ameliorator al solului. Adus pe 6 mai 2018, de pe: intagri.com



Nimeni nu a comentat acest articol încă.