
Formule, utilizări, riscuri de sulfură de sodiu
sulfură de sodiu (Na2S) este un solid cristalin de la galben la roșu cărămidă. În natură, acesta se găsește în diferite grade de hidratare, cel mai frecvent fiind sulfura de sodiu nonhidrat (Na2S 9H2O).
Sunt săruri solubile în apă care dau soluții puternic alcaline. Când sunt expuși la aerul umed, absorb umezeala din aer, putându-se încălzi spontan și provoca aprinderea materialelor combustibile din apropiere. La fel, în contact cu aerul umed, ele emit hidrogen sulfurat, care miroase a ouă stricate..

Sunt agenți de reducere puternici. Aceste substanțe pot fi periculoase pentru mediu, în special pentru organismele acvatice.
Monosulfura de sodiu este furnizată comercial sub formă de fulgi conținând 60-62% NaDouăS ...
- Formule

- CAS: 1313-82-2 Sulfură de sodiu (anhidră)
- CAS: 1313-84-4 Sulfură de sodiu (nonhidrat)
Structura 2D
Structura 3D

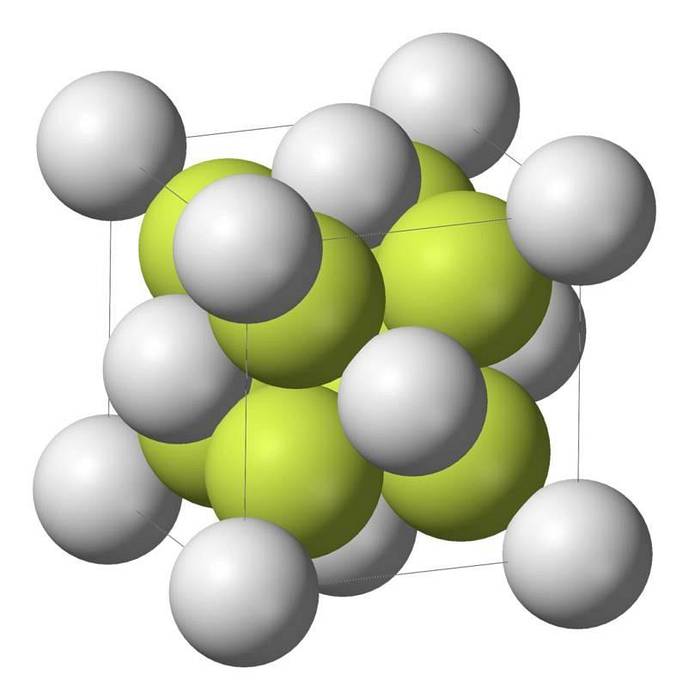
Caracteristicile sulfurii de sodiu
Proprietati fizice si chimice

Monosulfura de sodiu (Na2S) cristalizează cu structura antifluorită, în care fiecare atom de S este înconjurat de un cub de 8 atomi de Na și fiecare atom de Na de un tetraedru cu 4 atomi de S..
Inflamabilitate
Singurul membru foarte inflamabil al grupării sulfurii anorganice este hidrogenul sulfurat. Cu toate acestea, alte sulfuri anorganice, cum ar fi sulfura de sodiu, se pot încălzi spontan și chiar se pot aprinde dacă sunt expuse la umiditate..
Când este expus la foc, sulfura de sodiu degajă gaze sau vapori de dioxid de sulf, care sunt iritanti sau toxici.
Reactivitate
- Sulfurile anorganice sunt în general bazice (unele sunt puternic bazice și, prin urmare, incompatibile cu acizii).
- Mulți dintre acești compuși sunt agenți reducători (reacționează energic cu agenți oxidanți).
- Sărurile simple de sulfură (cum ar fi sulfura de sodiu, potasiu și amoniu) reacționează energic cu acizii pentru a elibera hidrogen sulfurat gaz foarte toxic și inflamabil..
- Sulfura de sodiu este inflamabilă. Poate exploda atunci când este încălzit rapid sau lovit.
- Când este încălzit până la descompunere, emite vapori toxici de oxid de sodiu și oxizi de sulf.
- Reacționează violent cu săruri de carbon, cărbune, diazoniu, N, N-diclorometilamină, oxidanți puternici și apă.
Toxicitate
Mulți dintre membrii grupului de sulfuri anorganice se comportă ca niște baze puternice și pot provoca arsuri severe la contactul cu pielea..
Această proprietate depinde de solubilitatea sa. Sulfurile anorganice mai insolubile (de exemplu, sulfura de mercur (II) și sulfura de cadmiu) nu sunt caustice.
Sulfura de sodiu are un coeficient mediu de partiție octanol / apă (Pow) (de -3,5). Această valoare este utilizată ca măsură a solubilității (și a bioconcentrării) unei substanțe în țesuturile grase animale (în special animalele acvatice)..
Sulfura de sodiu este considerată periculoasă pentru mediu, în special pentru organismele acvatice.
Aplicații
La domiciliu, sulfura de sodiu este utilizată în curățatoarele de scurgere, curățătoarele de uz casnic (pentru cuptor, baie), plăcile de îndreptat părul, săpunul pentru mașina de spălat vase și airbagurile pentru automobile..
În industrie, este utilizat în produsele de curățat, în ciment și ca precursor în producția altor substanțe chimice.
Efecte clinice
Expunerea la sulfura de sodiu este frecventă în țările dezvoltate și subdezvoltate, atât în industrie, cât și acasă. Aceste substanțe corozive sunt prezente în diferite produse de uz casnic în concentrații scăzute..
În țările dezvoltate, efectele grave sunt rare. Acestea apar în principal din ingestia deliberată a substanței chimice la adulți. Cu toate acestea, în țările în curs de dezvoltare, efectele severe sunt mai frecvente.
Corozivii alcalini provoacă necroză de lichefiere. Acestea saponifică grăsimile din membrana celulară, distrugând celula și permițând penetrarea profundă în țesutul mucoasei.
Expunere orală
Inflamația inițială apare în țesutul gastro-intestinal, urmată de necroză tisulară (cu posibilă perforație), apoi granulare și, în cele din urmă, formarea stricturii.
Pacienții cu ingestie ușoară dezvoltă iritații sau arsuri de gradul I (hiperemie superficială și edem) ale orofaringelui, esofagului sau stomacului..
Pacienții cu intoxicație moderată pot dezvolta arsuri de gradul II (vezicule superficiale, eroziuni și ulcerații) cu posibilă formare de strictură ulterioară (în special esofagiană)..
Unii pacienți (în special copii mici) pot dezvolta edem respirator superior.
Pacienții cu intoxicație severă prin ingestie pot dezvolta arsuri profunde și necroză a mucoasei gastro-intestinale, cu complicații precum: perforație (esofagiană, gastrică, rareori duodenală), formarea de fistule (traheoesofagiene, aortoesofagiene) și sângerări gastro-intestinale..
Se pot dezvolta: hipotensiune arterială, tahicardie, tahipnee, formare de strictură (în principal esofagiană), carcinom esofagian și edem respirator superior (care este frecvent și adesea pune viața în pericol).
Intoxicația severă se limitează, în general, la ingestii deliberate la adulți.
Expunere prin inhalare
Expunerea ușoară poate provoca tuse și bronhospasm.
Inhalarea severă poate provoca edem respirator superior, arsuri, stridor și, rareori, leziuni pulmonare acute..
Expunerea oculară
Poate provoca iritații conjunctivale severe și chimioză, defecte epiteliale ale corneei, ischemie limbică, pierderi vizuale permanente și în cazuri severe de perforație.
Expunere cutanată
Expunerea ușoară provoacă iritații și arsuri de grosime parțială. Acidoza metabolică se poate dezvolta la pacienții cu arsuri severe sau șoc..
Expunerea prelungită sau produsele cu concentrație ridicată pot provoca arsuri pe toată grosimea.
Siguranță și riscuri
Declarații de pericol ale Sistemului global armonizat de clasificare și etichetare a substanțelor chimice (GHS)
Sistemul global de armonizare a clasificării și etichetării substanțelor chimice (GHS) este un sistem agreat la nivel internațional, creat de Națiunile Unite și conceput pentru a înlocui diferitele standarde de clasificare și etichetare utilizate în diferite țări prin utilizarea unor criterii consistente la nivel global..
Clasele de pericol (și capitolul corespunzător al GHS), standardele de clasificare și etichetare și recomandările pentru sulfura de sodiu sunt următoarele (Agenția Europeană pentru Produse Chimice, 2017; Națiunile Unite, 2015; PubChem, 2017):







Referințe
- Benjah-bmm27, (2006). Fluorite-unit-cell-3D-ionic [imagine] Recuperat de pe: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [imagine] Recuperat de la: chem.nlm.nih.gov.
- ChemIDplus, (2017). Structura 3D a 1313-82-2 - Sulfură de sodiu [imagine] Recuperat de la: chem.nlm.nih.gov.
- ChemIDplus, (2017). Structura 3D a 1313-84-4 - Sulfură de sodiu [imagine] Recuperat de la: chem.nlm.nih.gov.
- Agenția Europeană pentru Produse Chimice (ECHA). (2017). Rezumatul clasificării și etichetării.
- Clasificare armonizată - Anexa VI la Regulamentul (CE) nr. 1272/2008 (Regulamentul CLP). Sulfură de sodiu. Adus la 16 ianuarie 2017, de pe: echa.europa.eu.
- Agenția Europeană pentru Produse Chimice (ECHA). (2017). Rezumatul clasificării și etichetării.
- Clasificare și etichetare notificate. Sulfură de sodiu, hidratată. Adus la 16 ianuarie 2017 de pe: echa.europa.eu.
- Banca de date privind substanțele periculoase (HSDB). TOXNET. (2017). Sulfid de sodiu. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: toxnet.nlm.nih.gov.
- Lange, L. și Triebel, W. (2000). Sulfuri, polisulfuri și sulfani. În Enciclopedia lui Ullmann de chimie industrială. Wiley-VCH Verlag GmbH & Co. KGaA. Recuperat de pe dx.doi.org.
- Națiunile Unite (2015). Sistemul armonizat global de clasificare și etichetare a substanțelor chimice (GHS) a șasea ediție revizuită. New York, UE: Publicația Națiunilor Unite. Recuperat de pe: unece.org.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date compusă PubChem. (2016). Sulfat de sodiu enneahidrat - Structura PubChem [imagine] Adus de la: pubchem.ncbi.nlm.nih.gov.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date compusă PubChem. (2017). Monosulfură de sodiu. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Centrul Național pentru Informații despre Biotehnologie. Baza de date compusă PubChem. (2017). Sulfat de sodiu enneahidrat. Bethesda, MD, UE: Biblioteca Națională de Medicină. Recuperat de la: pubchem.ncbi.nlm.nih.gov.
- Administrația Națională Oceanică și Atmosferică (NOAA). CAMEO Chemicals. (2017). Fișă tehnică chimică. Sulfură de sodiu, anhidră. Silver Spring, MD. EU; Recuperat de la: cameochemicals.noaa.gov.
- Administrația Națională Oceanică și Atmosferică (NOAA). CAMEO Chemicals. (2017). Foaie de date a grupului reactiv. Sulfuri, anorganici. Silver Spring, MD. EU; Recuperat de la: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [imagine] Recuperat de pe: wikipedia.org.
- PubChem, (2016). Monosulfură de sodiu [imagine] Recuperat de la: puchem.nlm.nih.gov.
- PubChem, (2016). Sulfat de sodiu enneahidrat [imagine] Recuperat de la: puchem.nlm.nih.gov.
- Wikipedia. (2017). Coeficientul de partiție octanol-apă. Adus la 17 ianuarie 2017, de pe: wikipedia.org.
- .



Nimeni nu a comentat acest articol încă.