
Ce este Molality? (cu exemple)
molalitatea, notat cu litera minusculă m, este un termen folosit pentru a descrie concentrația unei soluții. Poate fi definit ca numărul de moli ai unui dizolvat dizolvat în 1 kilogram de solvent.
Este egal cu moli de dizolvat (substanța care se dizolvă) împărțit la kilogramele de solvent (substanța utilizată pentru a se dizolva).
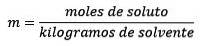
Unde moli de solut sunt date de ecuația:
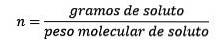
Deci, în cele din urmă, ecuația molalității este

Indice articol
- 1 Caracteristicile molalității
- 2 Diferențe și asemănări între molalitate (m) și molaritate (M)
- 3 Exemple de molalitate
- 3.1 Exemplul 1:
- 3.2 Exemplul 2:
- 3.3 Exemplul 3:
- 4 Referințe
Caracteristicile molalității
Molalitatea este o măsură a concentrației unui dizolvat într-o soluție. Se utilizează în principal atunci când temperatura este o problemă.

Molaritatea nu este la fel de obișnuită ca și omologul său, molaritatea (moli de dizolvat pe litru de solvent), dar este utilizată în calcule foarte specifice, în special în ceea ce privește proprietățile coligative (ridicarea punctului de fierbere, depresia punctului de fierbere)..
Deoarece volumul este supus variației datorită temperaturii și presiunii, molaritatea variază și în funcție de temperatură și presiune. În unele cazuri, utilizarea greutății este un avantaj, deoarece masa nu variază în funcție de condițiile de mediu..
Este important să se utilizeze masa solventului și nu masa soluției. Soluțiile etichetate cu concentrație molară sunt indicate cu litere mici m. O soluție de 1,0 m conține 1 mol de substanță dizolvată per kilogram de solvent.
Pregătirea unei soluții pentru o anumită molalitate este ușoară, deoarece necesită doar o scală bună. Atât solventul, cât și solutul sunt amestecate, mai degrabă decât măsurate în volum.
Unitatea SI (Sistem Internațional) pentru molalitate este mol / kg sau mol de solut pe kg de solvent. O soluție cu o molalitate de 1 mol / kg este adesea descrisă ca "1 molal" sau "1 m".
Cu toate acestea, urmând sistemul de unități SI, Institutul Național de Standarde și Tehnologie, care este autoritatea Statelor Unite în materie de măsurare, consideră că termenul „molală” și simbolul unității „m” sunt învechite și sugerează utilizarea mol / kg.
Diferențe și asemănări între molalitate (m) și molaritate (M)
Pregătirea unei soluții de o anumită molalitate implică cântărirea atât a solutului, cât și a solventului și obținerea maselor acestora..
Dar, în cazul molarității, se măsoară volumul soluției, ceea ce lasă loc variațiilor de densitate ca urmare a stării mediului de temperatură și presiune..
Aceasta înseamnă că este avantajos să lucrați cu molalitatea care se ocupă de masă, deoarece în compoziția chimică, masa unei substanțe pure cunoscute este mai importantă decât volumul acesteia, deoarece volumele pot fi modificate sub efectul temperaturii și presiunii, masa rămâne neschimbată.
Mai mult, reacțiile chimice au loc proporțional cu masa, nu cu volumul. Pentru a se baza pe masă, molalitatea poate fi ușor convertită într-un raport de masă sau o fracție de masă.
Pentru soluțiile apoase (soluții în care apa este solventul) aproape de temperatura camerei, diferența dintre soluțiile molare și molare este neglijabilă..
Acest lucru se datorează faptului că în jurul temperaturii camerei, apa are o densitate de 1 kg / L. Aceasta înseamnă că „per L” de molaritate este egal cu „per kg” de molalitate..
Pentru un solvent precum etanolul, unde densitatea este 0,789 kg / l, o soluție 1 M ar fi 0,789 m.
Partea importantă a amintirii diferenței este:
Molaritate - M → moli pe litru de soluție.
Molalitate - m → moli pe kilogram de solvent.
Exemple de molalitate
Exemplul 1:
Problemă: Care este molalitatea unei soluții care conține 0,086 moli de NaCI dizolvat în 25,0 g de apă?
Răspuns: Acest exemplu folosește ecuația directă a molalității:
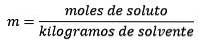
Moli de dizolvat (NaCl) = 0,086 mol
Masă (apă) = 25,0 g = 25,0 x 10-3 kg
Înlocuind avem:
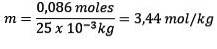
Exemplul 2:
Problemă: Care este molalitatea unei soluții dacă 124,2 grame de NaOH sunt dizolvate în 1,00 litri de apă? (Densitatea apei este egală cu 1,00 g / ml).
Răspuns: Apa este cunoscută sub numele de solvent universal și densitatea este de obicei dată la 1,00 grame pe mililitru, sau la fel ca 1 kilogram pe litru. Acest lucru facilitează conversia de la litri la kilograme..
În această problemă, cele 124,2 grame de NaOH vor trebui transformate în moli (pentru moli de solut) și un litru de apă va trebui transformat în kilograme (per kilogram de solvent) folosind densitatea.
Mai întâi, găsiți masa molară a NaOH:
P.MN / A= 22,99 g / mol
P.MSAU= 16 g / mol
P.MH= 1g / mol
P.MNaOH= 22,99 g / mol +16 g / mol +1 g / mol = 39,99 g / mol
În al doilea rând, convertiți grame de NaOH în moli, folosind masa molară:
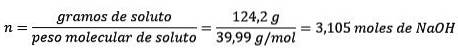
În al treilea rând, convertiți litrul de apă în kilograme folosind densitatea.
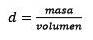
Rezolvarea pentru masă rămâne
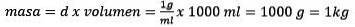
În cele din urmă, ecuația molalității este rezolvată:
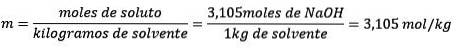
Exemplul 3:
Problemă: Care este masa de apă a unei soluții apoase care conține 0,52 grame de clorură de bariu (BaClDouă, PM = 208,23 g / mol) a cărei concentrație este de 0,005 mol / kg?
Răspuns: în acest caz concentrația molară este utilizată pentru a determina cantitatea de apă în soluție.
În primul rând, se obține numărul de moli de BaClDouă în soluție:
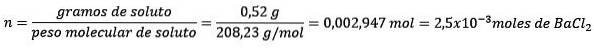
În al doilea rând, eliminați kilogramele de solvent din ecuația molalității și rezolvați pentru.
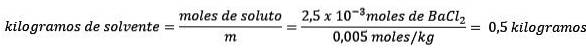
Referințe
- Note științifice și proiecte. (2015, 22 februarie). Exemplu de calcul al molalității. Recuperat de la sciencenotes.org.
- Bhardwaj, M. (2014, 26 noiembrie). Care este un exemplu de molalitate? Recuperat de la socratic.org.
- (S.F.). Molalitatea. Recuperat de la boundless.com.
- Helmenstine, T. (2017, 19 februarie). Care este diferența dintre molaritate și molalitate? Recuperat de la thoughtco.com.
- Formula Molalității. (S.F.). Recuperat de pe softschools.com.
- Molalitatea. (S.F.). Recuperat de la chemteam.l
- Ce este Molalitatea? (S.F.). Recuperat de la freechemistryonline.com.



Nimeni nu a comentat acest articol încă.