
Efecte de substituție nucleofilă aromatică, exemple
substituție nucleofilă aromatică (SNAr) este o reacție care are loc în chimia organică, care constă în deplasarea unui bun grup de părăsire de către un nucleofil care intră. Din punct de vedere al mecanismului său și al aspectelor electronice, este partea opusă substituției aromatice electrofile (SEAr).
În general, grupul care părăsește este un halogen, care apare ca un anion al halogenurii X-. Această reacție poate avea loc numai dacă inelul aromatic (în principal benzen) este deficitar în electroni; adică dacă are grupări substituente care retrag electronii.

Imaginea superioară prezintă cele spuse în paragraful anterior. Grupul de atragere a electronilor EWG (pentru acronimul său în engleză: Grupul de retragere a electronilor), activează inelul aromatic pentru atacul nucleofil al speciei negative Nu-. Se poate vedea că se formează un intermediar (în centru), din care se eliberează sau iese halogenura X.-.
Rețineți că, în termeni simpli, X este substituit cu Nu într-un inel aromatic. Această reacție este foarte versatilă și necesară în sinteza noilor medicamente, precum și în studiile de chimie organică sintetică..
Indice articol
- 1 Aspecte generale
- 1.1 Diferențe cu substituția aromatică electrofilă
- 2 Efecte
- 2.1 Din numărul de substituenți
- 2.2 Din grupul care pleacă
- 3 Exemplu
- 3.1 Comentariul final
- 4 Referințe
Caracteristici generale
Inelul aromatic poate fi „încărcat” sau „descărcat” de electroni în funcție de substituenții acestuia (cei care înlocuiesc legătura originală C-H).
Când acești substituenți pot dona densitatea electronilor către inel, se spune că îl îmbogățesc cu electroni; Dacă, dimpotrivă, sunt atractori ai densității electronilor (EWG menționat mai sus), atunci se spune că sărăcesc inelul de electroni.
În ambele cazuri, inelul este activat pentru o reacție aromatică specifică, în timp ce este dezactivat pentru celălalt..
De exemplu, un inel aromatic bogat în electroni se spune că este activ pentru substituția aromatică electrofilă; adică își poate dona electronii unei specii electrofile, E+. Cu toate acestea, nu va dona electroni unei specii Nu-, întrucât taxele negative s-ar respinge reciproc.
Acum, dacă inelul este sărac în electroni, nu are cum să le dea speciilor E+ (SEAr nu apare); pe de altă parte, are disponibilitatea de a accepta electronii speciei Nu- (SNAr este dezvoltat).
Diferențe cu substituția electrofilă aromatică
Odată ce aspectele generale de intrare au fost clarificate, unele diferențe între SNAr și SEAr pot fi acum enumerate:
- Inelul aromatic acționează ca un electrofil (cu deficit de electroni) și este atacat de un nucleofil.
- O grupă X care pleacă este substituită pe inel; nu un H+
- Carbocariile nu se formează, ci intermediari cu o sarcină negativă care poate fi delocalizată prin rezonanță
- Prezența mai multor grupuri atractive în inel accelerează substituția în loc să o încetinească
- În cele din urmă, aceste grupuri nu au efecte directe asupra locului (pe care carbon) va avea loc substituția. Înlocuirea va avea loc întotdeauna pe carbonul atașat la grupul X care pleacă.
Ultimul punct este, de asemenea, ilustrat în imagine: legătura C-X se rupe pentru a forma noua legătură C-Nu.
Editarea efectelor
Din numărul de substituenți
Bineînțeles, cu cât inelul este mai slab de electroni, cu atât rSNA este mai rapid și condițiile necesare pentru a apărea sunt mai puțin drastice. Luați în considerare următorul exemplu reprezentat în imaginea de mai jos:
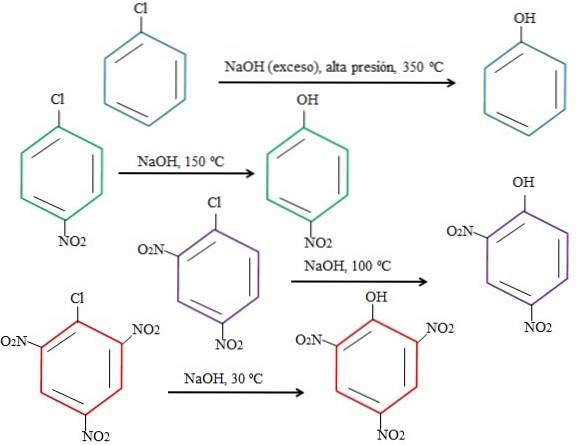
Rețineți că 4-nitroclorobenzenul (inel albastru) necesită condiții drastice (presiune ridicată și o temperatură de 350 ° C) pentru a avea loc înlocuirea Cl cu OH. În acest caz, clorul este grupul părăsit (Cl-) și hidroxidează nucleofilul (OH-).
Când apare grupul NODouă, care este un atractor de electroni (inel verde), substituția poate fi efectuată la o temperatură de 150 ° C la presiunea ambiantă. Pe măsură ce numărul de NO grupuri creșteDouă prezente (inele violet și roșu), înlocuirea are loc la temperaturi mai mici și mai mici (100ºC și respectiv 30ºC).
Prin urmare, grupurile NU suntDouă accelerați rSNA și privați inelul de electroni, făcându-l mai susceptibil la atacul OH-.
Pozițiile relative ale lui Cl față de NO nu vor fi explicate aici.Două în 4-nitroclorobenzen și cum acestea modifică viteza reacției; De exemplu, ratele de reacție ale 2-nitroclorobenzenului și 3-nitroclorobenzenului sunt diferite, acesta din urmă fiind cel mai lent în comparație cu ceilalți izomeri.
Din grupul de ieșire
Recuperând 4-nitroclorobenzen, reacția sa de substituție este mai lentă în comparație cu omologul său fluorurat:
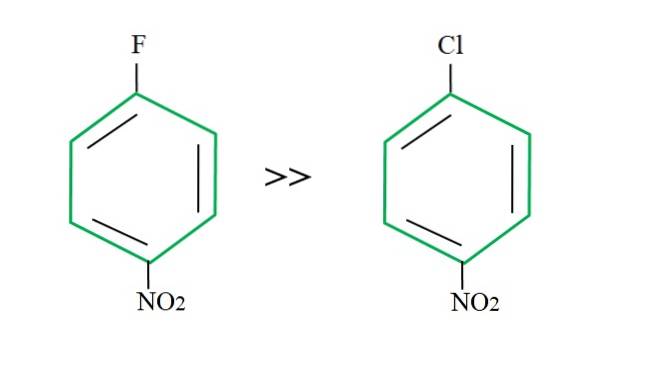
Explicația pentru acest lucru nu poate sta în nicio altă variabilă decât diferența dintre F și Cl. Fluorul este un grup de părăsire teribil, deoarece legătura C-F este mai greu de rupt decât legătura C-Cl. Prin urmare, ruperea acestei legături nu este etapa determinantă a vitezei pentru SNAr, ci adăugarea Nu- la inelul aromatic.
Deoarece fluorul este mai electronegativ decât clorul, atomul de carbon legat de acesta are un deficit electronic mai mare (Cδ+-Fδ-). În consecință, carbonul legăturii C-F este mult mai susceptibil de a fi atacat de Nu- decât cea a legăturii C-Cl. De aceea, înlocuirea lui F cu OH este mult mai rapidă decât cea a Cl cu OH.
Exemplu
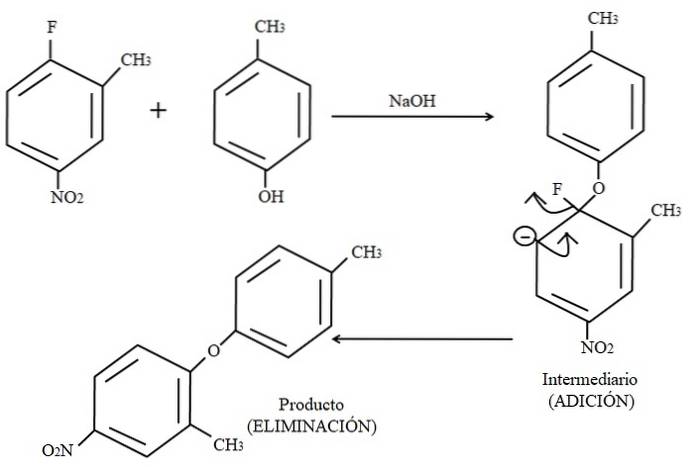
În cele din urmă, un exemplu al acestui tip de reacții organice este prezentat mai jos în imaginea de mai sus. Para-crezolul nu pare a fi un nucleofil; dar, deoarece există un mediu bazic, grupul său OH este deprotonat, lăsându-l ca un anion fenoxid, care atacă 2-metil-4-nitrofluorobenzen.
Când se produce acest atac, se spune că nucleofilul se adaugă la electrofil (inelul aromatic al 2-metil-4-nitrofluorobenzenului). Această etapă poate fi văzută în dreapta imaginii, unde compusul intermediar este format cu ambii substituenți aparținând inelului.
Când se adaugă para-crezol, apare o sarcină negativă care este delocalizată prin rezonanță în interiorul inelului (rețineți că acesta nu mai este aromat).
Numai ultima structură de rezonanță este prezentată în imagine, din care fluorul se termină ca F-; dar, în realitate, sarcina negativă menționată devine delocalizată chiar și în atomii de oxigen ai grupului NODouă. După etapa de adăugare vine etapa de eliminare, ultima, care este momentul în care produsul este în cele din urmă format.
Comentariu final
Grupul NUDouă restul poate fi redus la grupul NHDouă, și de acolo este posibil să se efectueze mai multe reacții de sinteză pentru a modifica molecula finală. Acest lucru evidențiază potențialul sintetic al rSNA și că mecanismul său constă, de asemenea, în doi pași: unul pentru adăugare și celălalt pentru eliminare..
În prezent, totuși, există dovezi experimentale și de calcul conform cărora reacția se desfășoară efectiv conform unui mecanism concertat, în care ambele etape apar simultan printr-un complex activat și nu printr-un intermediar..
Referințe
- Morrison, R. T. și Boyd, R, N. (1987). Chimie organica. Ediția a V-a. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organica. (Ediția a șasea). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organica. Amine. (Ediția a X-a.). Wiley plus.
- Wikipedia. (2019). Substituție aromatică nucleofilă. Recuperat de pe: en.wikipedia.org
- James Ashenhurst. (06 septembrie 2019). Substituție aromatică nucleofilă (NAS). Recuperat de pe: masterorganicchemistry.com
- Chimie LibreTexte. (05 iunie 2019). Înlocuirea aromatică nucleofilă. Recuperat de pe: chem.libretexts.org


Nimeni nu a comentat acest articol încă.